
【题目】发展混合动力车是实施节能减排的重要措施之一。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗。混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)电解液。镍氢电池充放电原理如下图,其总反应式为 H2+2NiOOH![]() 2Ni(OH)2,下列有关混合动力车的判断正确的是( )
2Ni(OH)2,下列有关混合动力车的判断正确的是( )
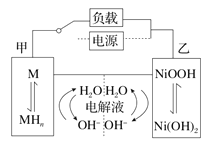
A.在上坡或加速时,乙电极周围溶液的pH将减小
B.在上坡或加速时,溶液中的K+向甲电极迁移
C.在刹车和下坡时,甲电极的电极反应式为2H2O+2e- =H2↑+2OH-
D.在刹车和下坡时,乙电极增重
【答案】C
【解析】
汽车上坡或加速时,电动机提供推动力为原电池,甲电极为负极,反应式为H2+2OH --2e- =2H2O;乙极为正极,反应式为2NiOOH+2H2O+2e -=2Ni(OH)2+2OH -;在刹车和下坡时,为电解池;
A.在上坡或加速时,乙极电极反应式为:2NiOOH+2H2O+2e -=2Ni(OH)2+2OH -,乙电极周围溶液的pH将增大,A错误;
B.在上坡或加速时,溶液中的K+向正极乙电极迁移,B错误;
C.在刹车和下坡时,甲电极为电解池的阴极,电极反应式为2H2O+2e-=H2↑+2OH-,C正确;
D.在刹车和下坡时,乙为电解池的阳极,Ni(OH)2变为NiOOH,质量减小,D错误;
答案选C。


科目:高中化学 来源: 题型:
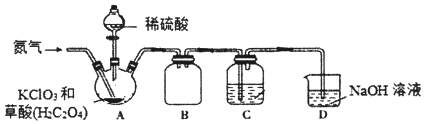
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
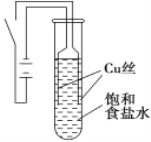
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜 | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
相同温度下CuCl的溶解度大于CuOH
下列说法错误的是
A.反应结束后最终溶液呈碱性
B.阴极上发生的电极反应为:2H2O + 2e═ H2↑+ 2OH
C.从实验看出氢氧化亚铜具有不稳定性
D.试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池正极板材料为 NiOOH,负极板材料为吸氢合金(MHn), 下列关于该电池的说法中正确的的是

A.放电时电池内部H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.放电时负极的电极反应式为:MHn-ne- =M + nH+
D.充电时阳极反应为:Ni(OH)2 + OH- -e- =NiOOH +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成抗抑郁药物吗氯贝胺
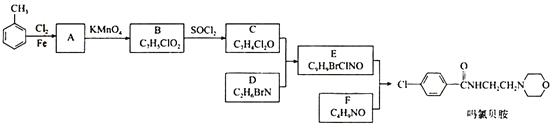
已知:
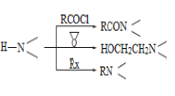
请回答:
(1)化合物B的官能团名称___________,![]() →A的反应试剂和条件是__________
→A的反应试剂和条件是__________
(2)化合物F的结构简式是______________________
(3)写出C+D→E的化学方程式____________________________________________
(4) 为探索新的合成路线,发现用化合物C与X(C6H14N2O)一步反应即可合成吗氯贝胺。请结合相关信息及知识,设计以环氧乙烷( ![]() )为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
)为原料合成X的合成路线_______________(用流程图表示,无机试剂任选)。
(5)符合以下条件的化合物X(C6H14N2O)可能的同分异构体有___________种。其中只有一条侧链的同分异构体的结构简式为________________
①分子中有一个六元环,且成环原子中最多含一个非碳原子。
②1H-NMR谱显示分子中有5种氢原子;IR谱表明分子中有N-N键,无O-H键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:
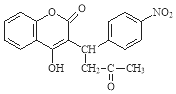
醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: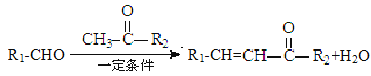
回答以下问题:
(1)反应①的反应类型是______。
(2)从A到B引入的官能团名称是______。
(3)物质C的结构简式为______。
(4)反应③的化学方程式为______。
(5)关于E物质,下列说法正确的是______(填字母序号)。
a 在核磁共振氢谱中有四组吸收峰
b 可以用酸性高锰酸钾溶液鉴别D和E
c 可以发生加成反应、聚合反应、氧化反应和还原反应
d 存在顺反异构
(6)分子结构中只含有一个苯环,且同时符合下列条件的G的同分异构体共有______种。
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。其中,苯环上的一氯代物只有两种的同分异构体的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu可形成多种配合物,某同学在探究配合物的形成时做了以下实验,根据下列信息回答问题:
(1)向盛有硫酸铜水溶液的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色的透明溶液,请写出先后发生反应的离子方程式___________。
(2)再向深蓝色透明溶液加入乙醇,析出深蓝色的晶体。深蓝色晶体的化学式为__________________。
(3)根据以上实验过程,判断NH3和H2O与Cu2+的配位能力:NH3________(填“>”“=”或“<”)H2O。
(4)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,某同学设计了如下实验:
a、分别取等质量的两种配合物晶体的样品配成待测溶液;
b、分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c、沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
。绿色晶体配合物的化学式为____________,由Cl所形成的化学键类型是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下KW=10-12,则0.05mol/LH2SO4溶液的pH=____ ,0.01mol/LNaOH溶液的pH=______ 。
(2)下列叙述中与盐类的水解有关的是(______)
①明矾和FeCl3可作净水剂
②实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释
③为保存FeCl3溶液,要在溶液中加少量盐酸
④用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全部有关
(3)若1 mol N2完全转化为NH3的反应热为△H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)已知25℃ 时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11 。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液④Na2CO3各25 mL,浓度均为0.1 mol·L-1四种溶液的pH由大到小的顺序为_________ (填序号)
(5)Na2CO3溶液加热后碱性增强,结合化学平衡移动原理解释原因:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
①A(g)+B(g)![]() 2C(g) ΔH1<0
2C(g) ΔH1<0
②X(g)+3Y(g)![]() 2Z(g) ΔH2>0
2Z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,C的物质的量不变
B.等压时,通入Z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入X气体,Y的物质的量浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com