
【题目】电解NaB(OH)4溶液制备H3BO3的原理如图所示,下列叙述错误的是( )

A. M室发生的电极反应式:2H2O﹣4e﹣=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 每生成1mol H3BO3,则有1mol Na+进入N室
【答案】B
【解析】
该装置有外加电源,因此该装置电解池,左端石墨为阳极,根据电解原理,阳极反应式为2H2O-4e-=O2↑+4H+,产品室得到产品,因此a膜为阳离子交换膜,右端石墨为阴极,根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,c膜为阳离子交换膜;
该装置有外加电源,因此该装置电解池,左端石墨为阳极,根据电解原理,阳极反应式为2H2O-4e-=O2↑+4H+,产品室得到产品,因此a膜为阳离子交换膜,右端石墨为阴极,根据电解原理,阴极反应式为2H2O+2e-=H2↑+2OH-,c膜为阳离子交换膜;
A、M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O﹣4e﹣═O2↑+4H+,故A说法正确;
B、原料室中的B(OH)4﹣通过b膜进入产品室,M室中氢离子通入a膜进入产品室,原料室中的Na+通过c膜进入N室,则a、c为阳离子交换膜,b为阴离子交换膜,故B说法错误;
C、N室中石墨为阴极,电解时阴极上水得电子生成H2和OH﹣,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室:a%<b%,故C说法正确;
D、理论上每生成1molH3BO3,则M室中就有1mol氢离子通入a膜进入产品室即转移1mole﹣,原料室中的1molNa+通过c膜进入N室,故D说法正确。


科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 能使甲基橙变为橙色的溶液:Na+、NH4+、CO32﹣、Cl﹣
B. 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42﹣、S2﹣、Cl﹣
C. 0.1molL﹣1 KOH溶液中:S2﹣、Na+、SO32﹣、NO3﹣
D. 常温下,![]() =1.0×1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
=1.0×1012的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生如下反应:mX(g)![]() nY(g) ΔH=QKJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法不正确的是
nY(g) ΔH=QKJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法不正确的是

A. 温度不变,压强增大,Y的质量分数减小
B. m>n
C. Q<0
D. 体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种盐的溶解度曲线,下列说法正确的是( )

A. 40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体
B. 20℃时,硝酸钾饱和溶液的质量分数是31.6%
C. 60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g硫酸铜晶体
D. 30℃时,将35g硝酸钾和35g 食盐同时溶于100g水中,溶液蒸发时,先析出的是氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6. 4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是____________________;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)= __________;
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
|
|
图1 | 图2 |
①该小组同学提出的假设是__________________________________________;
②请你帮助该小组同学完成实验方案,并填完表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||||
0.6mol·L-1 H2C2O4溶液 | H2O | 0.2mol·L-1 KMnO4溶液 | 3mol·L-1稀硫酸 | 向试管中加入少量固体 | ||
4 | 3.0 | 2.0 | 3.0 | 2.0 | _____________ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是( )

A. 达到平衡时,X、Y、Z物质的量之比为1:2:1
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,X平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法中正确的是
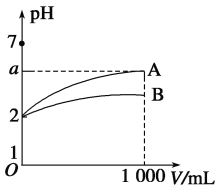
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. 若A、B都是弱酸,则6>a>2
D. 当a=5时,A是强酸,B是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com