
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
【答案】O3 -1160 6.2 18.4 大于; 温度升高,容积不变,总压强提高;二氧化氮二聚为放热反应,温度升高,平衡左移,体系的物质的量增加,总压强提高 49.98 AB
【解析】
(1)NO在空气中容易被一种三原子气体单质氧化剂氧化成NO2,则该氧化剂为O3;
(2)将已知方程式编号,①CH4(g)+4NO2(g) ![]() 4NOg)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NOg)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②2NO2(g)+N2(g) ![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
根据盖斯定律求所给反应的反应热;
(3)①开始时总压强为33.2kPa,其中氧气和一氧化氮等物质的量混和,故氧气和一氧化氮的分压都是16.6 kPa,根据反应方程式可知氧气与一氧化氮按物质的量之比是1:2反应,氧气减小的压强为16.6 kPa-11.4kPa=5.2 kPa,又因为压强之比等于物质的量之比,所以反应的一氧化氮减少的压强是5.2 kPa×2=10.4 kPa,则此时一氧化氮的压强是16.6 kPa-10.4kPa=6.2 kPa,因此此时反应速率v=4.2×10-2×p2(NO)×p(O2)= 4.2×10-2×(6.2 kPa)2×11.4kPa =18.4(kPa·min-1);
②由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度升高,平衡左移,体系的物质的量增加,总压强提高,所以若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃) 大于22.3kPa。
③根据表中数据可知一氧化氮和氧气完全反应时的压强是22.3 kPa,根据方程式可知完全反应时最初生成的二氧化氮的压强是16.6 kPa,剩余氧气压强16.6 kPa-8.3kPa=8.3kPa,总压强是16.6 kPa+8.3kPa=24.9 kPa,平衡后压强减少了24.9 kPa-22.3 kPa=2.6kPa,所以根据方程式2NO2(g) ![]() N2O4(g)可知平衡时N2O4对应的压强是2.6kPa,NO2对应的压强是16.6 kPa-2.6kPa×2=11.4 kPa,则反应N2O4(g)
N2O4(g)可知平衡时N2O4对应的压强是2.6kPa,NO2对应的压强是16.6 kPa-2.6kPa×2=11.4 kPa,则反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=![]() =49.98kPa。
=49.98kPa。
(4)A.由第一步反应快速平衡可知第一步反应的正、逆反应速率都较大,所以第一步的的逆反应速率大于第二步的反应速率;
B.根据第一步和第二步反应可知中间产物为N2O2;
C.化学反应中并不是所有碰撞有效;
D.第二步反应慢,所以第二步反应的活化能较高。
(1)NO在空气中容易被一种三原子气体单质氧化剂氧化成NO2,O3具有强氧化性,则该氧化剂的分子式为O3;
故答案为:O3;
(2)将已知方程式编号,①CH4(g)+4NO2(g) ![]() 4NOg)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NOg)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②2NO2(g)+N2(g) ![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
根据盖斯定律,①-②×2得:
CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的△H=(-574kJ·mol-1)-(+293kJ·mol-1)×2=-1160 kJ·mol-1,
2N2(g)+CO2(g)+2H2O(g)的△H=(-574kJ·mol-1)-(+293kJ·mol-1)×2=-1160 kJ·mol-1,
故答案为:-1160;
(3)①开始时总压强为33.2kPa,其中氧气和一氧化氮等物质的量混和,故氧气和一氧化氮的分压都是16.6 kPa,根据反应方程式可知氧气与一氧化氮按物质的量之比是1:2反应,氧气减小的压强为16.6 kPa-11.4kPa=5.2 kPa,又因为压强之比等于物质的量之比,所以反应的一氧化氮减少的压强是5.2 kPa×2=10.4 kPa,则此时一氧化氮的压强是16.6 kPa-10.4kPa=6.2 kPa,因此此时反应速率v=4.2×10-2×p2(NO)×p(O2)= 4.2×10-2×(6.2 kPa)2×11.4kPa =18.4(kPa·min-1);
故答案为:6.2;18.4;
②由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度升高,平衡左移,体系的物质的量增加,总压强提高,所以若升高反应温度至900℃,则
故答案为:大于;温度升高,容积不变,总压强提高;二氧化氮二聚为放热反应,温度升高,平衡左移,体系的物质的量增加,总压强提高;
③根据表中数据可知一氧化氮和氧气完全反应时的压强是22.3 kPa,根据方程式可知完全反应时最初生成的二氧化氮的压强是16.6 kPa,剩余氧气压强16.6 kPa-8.3kPa=8.3kPa,总压强是16.6 kPa+8.3kPa=24.9 kPa,平衡后压强减少了24.9 kPa-22.3 kPa=2.6kPa,所以根据方程式2NO2(g) ![]() N2O4(g)可知平衡时N2O4对应的压强是2.6kPa,NO2对应的压强是16.6 kPa-2.6kPa×2=11.4 kPa,则反应N2O4(g)
N2O4(g)可知平衡时N2O4对应的压强是2.6kPa,NO2对应的压强是16.6 kPa-2.6kPa×2=11.4 kPa,则反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=
2NO2(g)的平衡常数Kp=![]() =49.98kPa。
=49.98kPa。
故答案为:49.98;
(4)A.由第一步反应快速平衡可知第一步反应的正、逆反应速率都较大,所以第一步的的逆反应速率大于第二步的反应速率,故A正确;
B.根据第一步和第二步反应可知中间产物为N2O2,故B正确;
C. 化学反应中并不是所有碰撞都是有效碰撞,故C错误;
D.第二步反应慢,所以第二步反应的活化能较高,故D错误。
故答案为:AB。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如图所示,下列叙述错误的是( )

A. M室发生的电极反应式:2H2O﹣4e﹣=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 每生成1mol H3BO3,则有1mol Na+进入N室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为____________________________________________。
(2)1 mol CH2=CH-CH2OH中σ键和π键的个数比为___________,丙烯醇分子中碳原子的杂化类型为___________。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是______________________。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心原子的配位数是___________ ,与SCN-互为等电子体的分子为___________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___________。
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏加德罗常数的值,则Ni2+半径为___________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C. 18g水所含的原子数为NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需配制0.1mol/LNaOH溶液450mL,这是某同学转移溶液的示意图。

(1)仪器c使用前必须____。
(2)①图中的错误是____。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:____。
②根据计算得知,需称出NaOH的质量为____g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的___,溶液注入容量瓶前需恢复到室温,这是因为____;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作____;若加蒸馏水时不慎超过了刻度线___;若定容时俯视刻度线___;若配制完成后发现砝码和药品颠倒了(未使用游码),则结果____;若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_____。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.分析下列仪器装置图,回答下列问题:
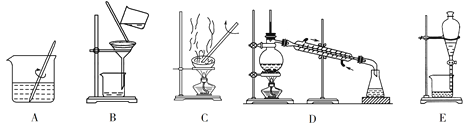
(1)粗盐的提纯需要上面的哪些装置?__________(填字母符号,下同)。
(2)分离以下混合物应该选择使用什么装置?
①酒精和水:_______;②食盐和水:_________;③花生油和水:_______。
Ⅱ.下图是为完成相应实验的装置图,请分析指出其中一处错误。
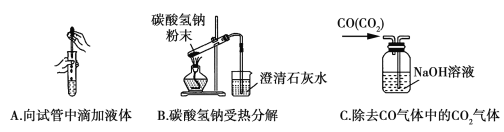
A:___________________________________;
B:___________________________________;
C:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com