
【题目】现需配制0.1mol/LNaOH溶液450mL,这是某同学转移溶液的示意图。

(1)仪器c使用前必须____。
(2)①图中的错误是____。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:____。
②根据计算得知,需称出NaOH的质量为____g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的___,溶液注入容量瓶前需恢复到室温,这是因为____;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作____;若加蒸馏水时不慎超过了刻度线___;若定容时俯视刻度线___;若配制完成后发现砝码和药品颠倒了(未使用游码),则结果____;若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_____。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____。
【答案】检查是否漏水 未用玻璃棒引流 药匙、胶头滴管、玻璃棒 2.0 B→C→A→F→E→D 将剩余的氢氧化钠全部转移到容量瓶中 溶液体积热胀冷缩,导致溶液浓度有偏差 偏低 偏低 偏高 无影响 偏高 重新配制溶液
【解析】
(1)仪器c是容量瓶,使用前必须检验是否漏水。
答案为:检查是否漏水;
(2)①配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅;配制溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.用到的仪器有:天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故还需:玻璃棒、钥匙、胶头滴管,
故答案为:未用玻璃棒引流;玻璃棒、药匙、胶头滴管;
②由于无450mL容量瓶,故要选用500mL容量瓶,配制出500mL0.1mol/L的NaOH溶液,所需的NaOH的物质的量n=cV=0.5L×0.1mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,
故答案为:2.0;
③配制一定物质的量浓度溶液所需的步骤是:计算→称量→溶解→冷却→转移→洗涤→振荡→定容→摇匀→移液,
故答案为:B→C→A→F→E→D;
(3)把洗涤液转移到容量瓶中,目的是将剩余的氢氧化钠全部转移到容量瓶中,减少误差,NaOH遇水放出大量的热,因为热胀冷缩,恢复到室温状态下,溶液的体积会减小,所配溶液溶度会偏大,
故答案为:将剩余的氢氧化钠全部转移到容量瓶中;溶液体积热胀冷缩,导致溶液浓度有偏差;
(4)没有洗涤,容量瓶中溶质的物质的量减少,因此所配溶液的浓度偏低;加蒸馏水超过刻度线,相当于对原溶液进行稀释,因此所配溶液的浓度偏低;定容时俯视刻度线,溶液的体积低于刻度线,所配溶液的浓度偏高;若配制完成后发现砝码和药品颠倒了(未使用游码),则药品的质量等于砝码的质量,没有带来误差,则结果无影响;若用天平称固体时,砝码上沾有油污,称量的溶质质量偏大,则所配制的溶液浓度将偏高。
故答案为:偏低、偏低、偏高;无影响;偏高;
(5)加水超过刻度线,说明实验失败,重新配制,
故答案为:重新配制溶液。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)Z(g)△H<0,一定温度下,在体积为2L的密闭容器中加入4mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列表述正确的是( )

A. 达到平衡时,X、Y、Z物质的量之比为1:2:1
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,X平衡转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅是一种重要的结构陶瓷材料,具有优良性能。
(1)基态氮原子的电子排布式为___________,基态硅原子未成对电子数是___________,碳、氮硅的电负性由大到小的顺序是___________。
(2)碳热还原法制氮化硅是在氮气中用碳还原SiO2,写出该反应的化学方程式:______________________。氮化硅一般不与酸反应,但能与氢氟酸反应,写出氮化硅与过量氢氟酸反应的化学方程式:______________________。
(3)三氯硅烷( SiHCl3)也可用于制备氮化硅,三氯硅烷分子的空间构型为___________,其分子中硅原子的杂化轨道类型为___________。
(4)氮化硅与碳化硅、氮化硼等作用可产生结合材料,改善性能。氮化硅、碳化硅的化学性质都很稳定,其原因是_________________________________。
(5)碳化硅立方晶系晶胞如图所示。C-Si-C键的夹角是___________,其晶体类型是___________,若立方晶系的碳化硅密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则晶胞的棱长为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物的结构可用“键线式”简化表示。如CH3—CH=CH-CH3可简写为 ![]() ,若有机物X的键线式为:
,若有机物X的键线式为:![]() ,则该有机物的分子式为________,其二氯代物有________种;Y是X的同分异构体,分子中含有1个苯环,写出Y的结构简式__________________________,Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:__________________________________。
,则该有机物的分子式为________,其二氯代物有________种;Y是X的同分异构体,分子中含有1个苯环,写出Y的结构简式__________________________,Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:__________________________________。
Ⅱ.以乙烯为原料合成化合物C的流程如下所示:
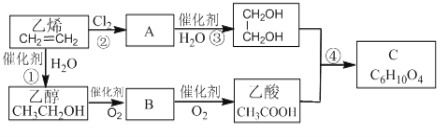
(1)乙醇和乙酸中所含官能团的名称分别为_____________和_____________。
(2)B物质的结构简式为________________。
(3)① 、④的反应类型分别为______________和_______________。
(4)反应②和④的化学方程式分别为:
②__________________________________________________________。
④___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH >0,下列叙述正确的是
2Z(g)+W(s) ΔH >0,下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 升高温度,正反应速率增大,逆反应速率减小 ,平衡正向移动。
C. 当容器中气体压强不变时,反应达到平衡
D. 平衡后加入X,上述反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
(实验一)实验室通过如如图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com