
【题目】硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
(实验一)实验室通过如如图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
【答案】控制反应温度、调节酸的滴加速度或调节酸的浓度等 安全瓶,防止倒吸 NaOH溶液 关闭K2,打开K1 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸 酸式滴定管 滴入最后一滴硝酸银溶液,出现黄色沉淀,且半分钟内沉淀不消失 否
【解析】
a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(1)控制反应温度、调节酸的滴加速度或调节酸的浓度来控制SO2生成速率;
(2)由仪器结构特征,b装置为安全瓶,防止溶液倒吸;
(3)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;关闭K2打开K1拆除装置,防止污染空气;
(4)Na2S2O3晶体易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4;
(5) AgNO3溶液显酸性,用酸式滴定管滴定;Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
(6)计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量与废水中氰化钠的最高排放标准为0.50mg/L比较判断是否符合排放标准。
a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气。
(1)实验中要控制SO2生成速率,可采取的措施有:控制反应温度、调节酸的滴加速度或调节酸的浓度等;
(2)由仪器结构特征,可知b装置为安全瓶,起到防止倒吸的作用;
(3)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用NaOH溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1,防止拆除装置时污染空气;(4)根据:Na2S2O35H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4;
(5) AgNO3溶液水解显酸性,所以盛装标准AgNO3溶液应该使用酸式滴定管;Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀半分钟内沉淀不消失,说明反应到达滴定终点;
(6)消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为![]() ==0.735mg/L>0.50mg/L,故处理后的废水未达到达到排放标准。
==0.735mg/L>0.50mg/L,故处理后的废水未达到达到排放标准。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】现需配制0.1mol/LNaOH溶液450mL,这是某同学转移溶液的示意图。

(1)仪器c使用前必须____。
(2)①图中的错误是____。除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:____。
②根据计算得知,需称出NaOH的质量为____g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的___,溶液注入容量瓶前需恢复到室温,这是因为____;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作____;若加蒸馏水时不慎超过了刻度线___;若定容时俯视刻度线___;若配制完成后发现砝码和药品颠倒了(未使用游码),则结果____;若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将_____。
(5)若实验过程中加蒸馏水时不慎超过了刻度线应如何处理?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.1000mol·L1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.分析下列仪器装置图,回答下列问题:
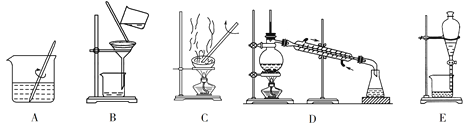
(1)粗盐的提纯需要上面的哪些装置?__________(填字母符号,下同)。
(2)分离以下混合物应该选择使用什么装置?
①酒精和水:_______;②食盐和水:_________;③花生油和水:_______。
Ⅱ.下图是为完成相应实验的装置图,请分析指出其中一处错误。
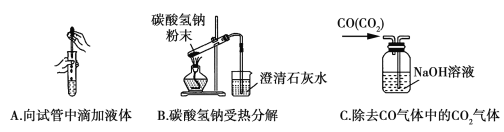
A:___________________________________;
B:___________________________________;
C:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

(1)操作①的名称是_____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是_____。
(3)加入试剂a所发生反应的化学方程式为_______________________。加入试剂b所发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要80 mL 1 mol·L1的稀硫酸,要用98%的浓硫酸(密度为1.84 g·cm3)来配制。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒 ⑧80 mL容量瓶。按使用仪器的先后顺序排列正确的是
A. ④③⑦⑧⑥ B. ②⑤⑦⑥ C. ①③⑧⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氧气的反应:2H2O2=2H2O+O2↑下列条件下,反应的速率最快的是( )
选项 | H2O2的质量分数 | 温度 | 催化剂 |
A | 5% | 5℃ | MnO2 |
B | 5% | 40℃ | MnO2 |
C | 10% | 5℃ | 无 |
D | 10% | 40℃ | MnO2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com