
【题目】Ⅰ.分析下列仪器装置图,回答下列问题:
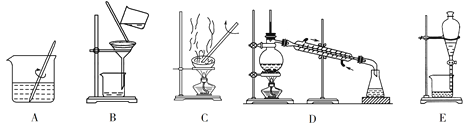
(1)粗盐的提纯需要上面的哪些装置?__________(填字母符号,下同)。
(2)分离以下混合物应该选择使用什么装置?
①酒精和水:_______;②食盐和水:_________;③花生油和水:_______。
Ⅱ.下图是为完成相应实验的装置图,请分析指出其中一处错误。
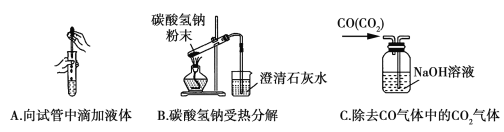
A:___________________________________;
B:___________________________________;
C:___________________________________。
【答案】ABCDCE滴管口伸入试管中试管口向上混合气体从短导管进入洗气瓶
【解析】
Ⅰ.上述装置中,A为溶解,B为过滤,C为蒸发,D为蒸馏,E为分液。
(1)粗盐提纯需要溶解(A)后,过滤(B)除去不溶性杂质,蒸发(C)得到食盐(不纯),故答案为:ABC;
(2)①酒精和水互溶,但沸点不同,利用蒸馏分离,故答案为:D;
②食盐溶于水,应选蒸发分离出NaCl,故答案为:C;
③花生油和水不混溶,混合物会分层,应选分液法分离,故答案为:E;
Ⅱ.A.为防止污染试剂,胶头滴管不能插入试管中,故答案为:滴管口伸入试管中;
B.加热固体,试管口应略向下倾斜,否则可能导致试管炸裂,故答案为:试管口向上;
C.导管应长进短出,否则不能起到洗气的作用,故答案为:混合气体从短导管进入洗气瓶。


科目:高中化学 来源: 题型:
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为___________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
2NO2(g)+N2(g)![]() 4NO(g) △H=+293kJ·mol-1
4NO(g) △H=+293kJ·mol-1
则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的△H=___________kJ·mol-1
(3)800℃时,在刚性反应器中以投料比为1︰1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。

①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52min时,测得体系中p(O2)=11.4kPa,则此时的p(NO)=___________kPa, v=___________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)______(填“大于”等于”或“小于”)22.3kPa,原因是______________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=___________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)→2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)→2NO2(g) 慢反应
下列表述正确的是___________(填标号)。
A.v(第一步的逆反应)>v第二步反应
B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效
D.第二步反应活化能较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH >0,下列叙述正确的是
2Z(g)+W(s) ΔH >0,下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 升高温度,正反应速率增大,逆反应速率减小 ,平衡正向移动。
C. 当容器中气体压强不变时,反应达到平衡
D. 平衡后加入X,上述反应的ΔH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸利多卡因(F)可用于急性心肌梗塞后室性早搏和室性心动过速,合成路线如下:

回答下列问题:
(1)A的化学名称为_________。
(2)反应①所需试剂、条件分别为_________、_________。
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有_________种(不考虑立体异构)、其中官能团的名称是_________。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸氢钠溶液反应可放出CO2气体。
(4)C的结构简式为_________。
(5)ClCH2COCl与足量NaOH溶液共热充分反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的分子式为C8H10
B. “PX”的二氯代物共有6种(不考虑立体异构)
C. “PX”分子中,最多有14个原子共面
D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
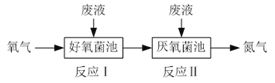
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
(实验一)实验室通过如如图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com