
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项 | A | B | C | D |
实验 | 用CCl4提取溴水中的Br2 | 除去乙醇中的苯 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.1000mol·L1 K2Cr2O7溶液 |
装置或仪器 |
|
|
|
|
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(反应中的其他产物已略去)。请填空:
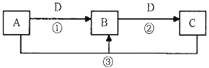
(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是________。
②若D是强碱,则反应②的离子方程式是___________________________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体;B是汽车尾气之一,遇空气会变色;则反应①的化学方程式为_________________。
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是_____________________________。
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是_____________________。
②若A是某强酸的稀溶液,则A的化学式可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7 g铝放入足量氢氧化钠溶液中完全反应后,在标准状况下,生成气体的体积是( )
A.1.12 LB.2.24 LC.3.36 LD.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化钙(CaC2)是重要的基本化工原料,工业上主要用于生产乙炔,进而用于生产其他有机物。以碳化钙为原料生产聚1,3-丁二烯(![]() )的合成路线如下图所示。回答下列问题:
)的合成路线如下图所示。回答下列问题:

(l)写出碳化钙生成乙炔的化学方程式:______________。
(2)A的结构简式为______________;①和②的反应类型分别为_______、_______。
(3)若聚1,3-丁二烯的平均相对分子质量为27000,则n=______________。
(4)三分子乙炔在一定条件下可聚合成环状分子,该分子的结构简式可表示为______________。
(5)以丙炔和溴苯为原料(无机试剂任选),设计制备正丙苯的合成路线:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com