
【题目】室温下,pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法中正确的是
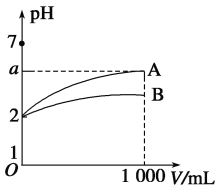
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. 若A、B都是弱酸,则6>a>2
D. 当a=5时,A是强酸,B是弱酸
【答案】D
【解析】
酸液稀释1000倍,强酸中不存在电离平衡,因此c(H+)变为原溶液的1/1000,即pH增大3个单位;而弱酸中存在电离平衡,稀释时电离平衡正向移动,导致c(H+)减小程度小于稀释的倍数,即pH的增大小于3个单位,据此解题。
A、室温下,pH=2的A、B两种酸溶液酸液稀释1000倍,A溶液pH变化较B大,说明两者酸性不同,即电离程度不同,若A、B两种酸pH=2,则浓度一定不相等,故A错误;
B、稀释后A酸的pH更大,说明c(H+)比B小,因此稀释后A酸溶液的酸性比B酸溶液弱,故B错误;
C、若A、B都是弱酸,弱酸中存在电离平衡,稀释时电离平衡正向移动,导致c(H+)减小程度小于稀释的倍数,所以pH的增大小于3个单位,即5>a>2,故C错误;
D、A、B两种酸分别稀释1000倍,强酸中不存在电离平衡,因此c(H+)变为原溶液的1/1000,即pH增大3个单位,若a=5,则A是强酸;而弱酸中存在电离平衡,稀释时电离平衡正向移动,导致c(H+)减小程度小于稀释的倍数,即pH的增大小于3个单位,从图中可知B稀释后pH小于a,所以B为弱酸,故D正确;
综上所述,本题应选D。


科目:高中化学 来源: 题型:
【题目】根据下列五种短周期元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在这五种元素中,最可能处于同一族的两种元素是_________(填元素符号),S元素最可能是_____区元素
(2)基态Q元素原子的价电子排布式是____________。Q和T同周期。化合物QT中T元素的化合价为_______;第一电离能介于Q、T之间的同周期元素有______种。
(3)化合物RT3中化学键类型为_______,RT3的阴离子的几何构型为________。
(4)下列元素中,化学性质和物理性质最像U元素的是_____________
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为_____;列式并计算晶体X的密度(g·cm-3)_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如图所示,下列叙述错误的是( )

A. M室发生的电极反应式:2H2O﹣4e﹣=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 每生成1mol H3BO3,则有1mol Na+进入N室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:

(1)图1中一定为饱和溶液的是_____。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为甲___乙。(大于、等于、小于)
(3)图3中表示乙的溶解度曲线是____(填曲线代码);P点表示的含义是_____。
(4)由图3知,30℃时,将20g甲固体溶于20g水,所得溶液的溶质质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从酯类化合物A出发,一定条件下可发生如下的物质相互转化。完成下列填空:
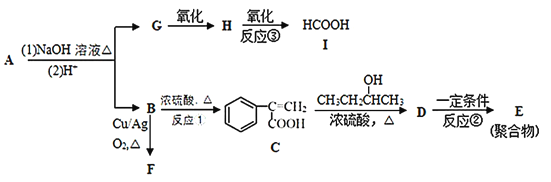
![]() 化合物G的名称是______,C中含氧官能团的名称是______。
化合物G的名称是______,C中含氧官能团的名称是______。
![]() 反应
反应![]() 的反应类型是______,反应
的反应类型是______,反应![]() 所需试剂与条件是______。
所需试剂与条件是______。
![]() 书写反应
书写反应![]() 的化学方程式______
的化学方程式______
![]() 写出A的结构简式______。
写出A的结构简式______。
![]() 写出一种C的苯环上只有一个侧链并可发生水解的同分异构体的结构简式______。
写出一种C的苯环上只有一个侧链并可发生水解的同分异构体的结构简式______。
![]() 设计一条由
设计一条由![]() 为原料制备
为原料制备![]() 的合成路线__________________。
的合成路线__________________。![]() 合成路线常用的表示方式为:
合成路线常用的表示方式为:![]() 目标产物
目标产物![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
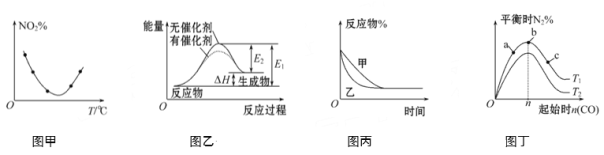
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,则P乙>P甲
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据科技日报网报道南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现丙烯醇高效、绿色合成。丙烯醇及其化合物可合成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的丙烯醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的电子排布式为____________________________________________。
(2)1 mol CH2=CH-CH2OH中σ键和π键的个数比为___________,丙烯醇分子中碳原子的杂化类型为___________。
(3)丙醛(CH3CH2CHO的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是______________________。
(4)羰基镍[Ni(CO)4]用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是___________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]-和[Ni(CN)4]2-等。[Ni(NH3)6]2+中心原子的配位数是___________ ,与SCN-互为等电子体的分子为___________。
(6)“NiO”晶胞如图所示。

①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为___________。
②已知:氧化镍晶胞密度为dg/cm3,NA代表阿伏加德罗常数的值,则Ni2+半径为___________nm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com