
����Ŀ��Ϊ���о���������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ��������ʵ�飬��ش��������⡣
��� | ���� | ʵ������ |
�� | �ֱ����Թ�A��B�м���5mL 5% H2O2��Һ��������2�ε�Ũ�� FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��н��ݣ����Թ�B����ʢ��40��������ˮ���ձ��н��� | �Թ�A�в��ٲ������ݣ��Թ�B�в��������������� |
�� | ��ȡ��֧�Թֱܷ����5mL 5% H2O2��Һ��5mL 10% H2O2��Һ | �Թ�A��B�о�δ���Լ��������ݲ��� |
��1����������ֽ�Ļ�ѧ����ʽΪ ��
��2��ʵ��ٵ�Ŀ���� ��
��3��ʵ���δ�۲쵽Ԥ�ڵ�ʵ������Ϊ�˰�����ͬѧ�ﵽʵ��Ŀ�ģ�������Ķ����������ĸĽ������ ����ʵ�����ṩ���Լ�����
��4������H2O2�ֽⷴӦ��Cu2+Ҳ��һ���Ĵ����ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ������ش�������⣺

�ٶ��Է�������ͼ��ͨ���۲� �����ԱȽϵó���������ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ�������������� ��
�ڶ�����������ͼ����ʾװ��������ʵ�飬ʵ��ʱ��������40 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԡ�ʵ������Ҫ������������_________________________��
���𰸡���1��2H2O2 ![]() 2H2O+O2�� ��д��MnO2�����֣�
2H2O+O2�� ��д��MnO2�����֣�
��2���о��¶ȶ�H2O2�ֽ����ʵ�Ӱ��
��3������֧�Թ�ͬʱ����ʢ����ͬ�¶���ˮ���ձ��л� ����֧�Թ���ͬʱ����2��1mol/LFeCl3��Һ���۲�������ݵ�����
��4���� ��Һ�����ݲ��������ʣ��ų�Cl�� �ĸ��ţ��� �ų��������ӵ���ͬ�����ĸ��ţ��������ɣ� �� �ռ�40mL���������ʱ��
��������
�����������1����������ֽ�����ˮ���������÷�Ӧ�Ļ�ѧ����ʽΪ2H2O2 ![]() 2H2O+O2����
2H2O+O2����
��2������ʵ�����Ĺ��̿���֪������ʵ�����ڲ�ͬ���¶��½���ʵ�飬���Կ����жϸ�ʵ������֤�¶ȶԹ�������ֽ����ʵ�Ӱ�������ʵ��ٵ�Ŀ�����о��¶ȶ�H2O2�ֽ����ʵ�Ӱ����
��3������������Һ�ķֽ����ʽ��������Կ��Խ���������ͭ��Һ�������жϣ��ʿ������ʵ�����£�����֧�Թ�ͬʱ����ʢ����ͬ�¶���ˮ���ձ��У�������֧�Թ���ͬʱ������ͬ������Ũ��һ��������ͭ��Һ���������ݵ����ʿ����10%��H2O2��Һ����֮��5%��H2O2��Һ��
��4����������Է����������Ը��ݲ������ݵ������������жϷ�Ӧ�Ŀ��������ڼ�����Ȼ���������ͭ�������Ӳ�ͬ������Ϊ�ų������ӵĸ�����������FeCl3��ΪFe2(SO4)3��
���������������Ӧ�Ŀ�����������ͨ���ⶨ�ռ�40mL�����������ʱ�������ж���ʱ�����Ӧ����


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д����
��1��һ��10���ӵ������ӵķ���_________��
��2������10���ӵ������ӵĵ���ʽ___________��
��3������10���ӵĹ��ۻ�����ĵ���ʽ_______��
��4���ĺ�10���ӵ������ӵĵ���ʽ��__________��
��5���ĺ�10���ӵĹ��ۻ�����Ľṹʽ_________��
��6�����10���ӵ������ӵĻ�ѧʽ___________��
��7�����10���ӵĹ��ۻ�����Ľṹʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��ش��������⣨����ʱ�þ���Ԫ�ط��ű�ʾ����
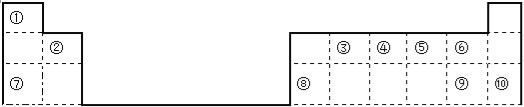
��1�������ֱ�ע��Ԫ����ԭ�Ӱ뾶��С���� ���뾶������ ����ѧ�������ȶ����� ���ǽ�������ǿ���� ������������Ӧ��ˮ����������ǿ���� ��
��2�������������Ľṹʽ ������������������ȼ�ղ���ĵ���ʽ
��3����ҵ��ȡ�������Ļ�ѧ����ʽ
ʵ������ȡ�������Ļ�ѧ����ʽ
�������뵥����������������Ӧ��ˮ��������ӷ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��5���л���ѧ����]����ȩ��������İٺ���ζ����Ƥ���Ĵ̼���С���Լ��ȶ����㷺���ڰٺϡ����㡢�������軨�Լ������������������������㾫�ĺϳɡ�������������ϴ�Ӽ������ϣ��������������ͻ�ױƷ�����ϡ���ϳ�·������ͼ��ʾ��

��1��B�й����ŵ������� ��
��2�����ķ�Ӧ������ ��
��3��д����Ӧ���Ļ�ѧ����ʽ ��
��4��������Ʒ�Ľṹʽ��ͼ��ʾ�������ȡ������ �֣�

����ȩ��ˮ��Һ�백ˮ����������Ƶ�������Ʒ���÷�Ӧ�Ļ�ѧ����ʽ ��
��5��д����������������A��ͬ���칹��
����������ȡ������ ����ȡ��������λ��
��6����֪��![]() �������������̣�д����CH3CH2CHOΪԭ���Ʊ�������
�������������̣�д����CH3CH2CHOΪԭ���Ʊ������� �ĺϳ�·������ͼ�����Լ�������ѡ����
�ĺϳ�·������ͼ�����Լ�������ѡ����
CH3CH2CHO�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��(��SiO2)��Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ���ͬѧ���������ͼʵ�飺

�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84g���ڿ��������½������գ�����Cu��Fe3O 4��SO2���壬ʵ���ȡd����Һ��1/10 ������ƿ�У���0.05mol/L ������Һ���еζ������ı���Һ 20mL��
��ش��������⣺
��1������Ʒ��ϸ���ٷ�Ӧ����Ŀ����________________________��
��2��װ��a��c�����÷ֱ���_______��________(���ţ����Զ�ѡ)��
a����ȥSO2���� b����ȥ�����е�ˮ���� c��������������
d�������ڹ۲�������� e����ȥ��Ӧ����������
��3���ζ����յ�ʱ��������________________________��
��4��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����_____________________��
��5��ͨ�������֪���û�ͭ��Ĵ���Ϊ________________________��
��ͬѧ�ڼ�ͬѧʵ��Ļ����ϣ������������ײ�ͬ�����շ������������ղ�������йش�����ͬ��Ҳ����˻�ͭ��Ĵ��ȡ�
��6������һ��������ͼװ���������ʵ��װ�� d��ͬ�����Դﵽʵ��Ŀ����______(�����)��

��7������������ԭװ�� d �е���Һ��ΪBa(OH)2������õĻ�ͭ��ȴ������+1%��������ʵ���������ȷ�����ܵ�ԭ����Ҫ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о����֣��ø�Ĥ��ⷨ������Ũ����ȩ��ˮ���й������̼���Ľϵ͵��ŵ㣬��ԭ����ʹ��ȩ�ֱ�����������������Ӧ��ת��Ϊ�Ҵ������ᣬ�ܷ�ӦΪ��2CH3CHO + H2O![]() CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
ʵ�����У���һ��Ũ�ȵ���ȩ��Na2SO4��ҺΪ�������Һ��ģ����ȩ��ˮ�Ĵ������̣���װ��ʾ��ͼ����ͼ��ʾ��
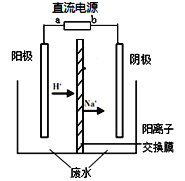
��1�����Լ���ȼ�ϵ��Ϊֱ����Դ����ȼ�ϵ����b��Ӧͨ�� ���ѧʽ�����塣
��2���������У��������ֱ�����������Ҵ��⣬��������ɫ���塣�缫��Ӧ���£�
�������� 4OH����4e����O2��+2H2O
�� ��
�������� ��
��CH3CHO+2e��+2H2O��CH3CH2OH+2OH��
��3���������У�������Na2SO4�����ʵ��� ������������������С����������������
��4���������У�ijʱ�̲ⶨ����������Һ�и���ֵ����ʵ���������Na2SO4��CH3COOH�����ʵ�����ͬ�����й�����������Һ�и���Ũ�ȹ�ϵ��˵����ȷ���� ������ĸ��ţ���
a. c(Na+)��һ����c(SO42��)��2��
b. c(Na+)��2c(CH3COOH)+2c(CH3COO��)
c. c(Na+)+c(H+)��c(SO42��)+c(CH3COO��)+c(OH��)
d. c(Na+)��c(CH3COOH)��c(CH3COO��)��c(OH��)
��5����֪����ȩ���Ҵ��ķе�ֱ�Ϊ20.8����78.4�����ӵ�������������Һ�з�����Ҵ���Ʒ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з����˷ܼ�����ʧ��ƽ��Ҳ�ܻ����������¡�ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵���У���ȷ����( )
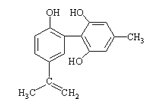
A���������Ը��������Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
B��1mol�����ʷֱ���Ũ��ˮ��H2��Ӧʱ���������ˮ��H2�ֱ�Ϊ4mol��7mol
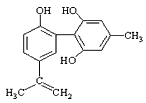 C���������뱽������ͬϵ���FeCl3��Һ����ɫ
C���������뱽������ͬϵ���FeCl3��Һ����ɫ
D���÷����е�����̼ԭ�Ӳ����ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ļ���������������������������е���ϵ����ش��������⣺
��1���ڿ�����������ĸ���ָ���У���SO2��NO2��ָ����SO2��һ����ɫ�ж����壬NO2��һ�� (������ɫ����������ɫ��)�ж����壻
��2��������������ˮ����ˮ��Һ�� (������������������������)�ԣ�
��3������ʱ��Ũ�������̼������Ӧ��C+2H2SO4(Ũ)![]() CO2��+2SO2��+2H2O���ڸ÷�Ӧ����ŨH2SO4���ֳ� (������ˮ��������ˮ������������)�ԡ�
CO2��+2SO2��+2H2O���ڸ÷�Ӧ����ŨH2SO4���ֳ� (������ˮ��������ˮ������������)�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������̿���Ҫ�ɷ�ΪMnO2������������ز����������У�������18����MnO2��3����KOH����Ϊ������������������Cu��Pb�Ļ�����ȣ�������ɻ�����ȡMnCO3��������ͼ��

��1��������ص�������ǿ������Һ��������йأ��������������������Խ�ǿ��ͨ�������ữ������ص�����
��2����ȥ��Һ1��Cu2�������ӷ���ʽ��
��3����ʵ��֤����MnO2�Թ���ʱ����ʼH2SO4��FeSO4�����Һ��c��H������![]() <0.7ʱ����Һ1���ܹ��������Fe
<0.7ʱ����Һ1���ܹ��������Fe![]() ��
��![]() ��0.7ʱ����Һ1�в��ܼ������Fe2��������������Ϣ�ش��٢ڢ���
��0.7ʱ����Һ1�в��ܼ������Fe2��������������Ϣ�ش��٢ڢ���
������Fe2���Ƿ�������ȫ��ʵ�������__________��
������ʱH2SO4��FeSO4�����Һ��c��H������c��Fe2����������0.7��1֮�䣬���˹�����ӽ�ԼҩƷ�ĽǶȷ�����ԭ����__________��
����c��H������c��Fe2����>1������c��H������c��Fe2������0.7��1���������Լ��ǣߣ�����ţ�
a��NaOH��Һ B������ c��MnO��
��4��д����Һ2�м������NH4HCO3��Ӧ�����ӷ���ʽ__________��
��5�����������̻����ʿɴ�95����������1740 kg�����࣬������MnCO3__________kg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com