
【题目】一氧化碳被广泛应用于冶金工业和电子工业。
(1)己知CO的燃烧热为283kJ/mol,请写出体现CO燃烧热的热化学方程式___________。
(2)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol
CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s)△H=bkJ/mol
请写出CO直接将Fe2O3还原为Fe的热化学方程式:____________(用含a,b的代数式表示△H的数值)。
(3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图所示。这种传感器利用燃料电池原理,则该电池的负极反应式为_________。
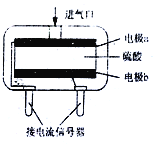
【答案】 CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol 9CO(g)+3Fe2O3(s)=9CO2(g)+6Fe(s) △H=(2a+b)kJ/mol CO+H2O-2e-=CO2+2H+
【解析】(1)己知CO的燃烧热为283kJ/mol,则CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol;(2)已知:①4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol,②CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s) △H=bkJ/mol,根据盖斯定律可知将“①×![]() +②×
+②×![]() ”即能得3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H=(2a+b)/3 kJ·mol-1。(3)CO在负极上发生氧化反应,据得失电子守恒有CO-2e――CO2,再据电荷守恒有CO-2e――CO2+2H+,最后据原子守恒得CO+H2O-2e-=CO2+2H+。
”即能得3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H=(2a+b)/3 kJ·mol-1。(3)CO在负极上发生氧化反应,据得失电子守恒有CO-2e――CO2,再据电荷守恒有CO-2e――CO2+2H+,最后据原子守恒得CO+H2O-2e-=CO2+2H+。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如下图所示。
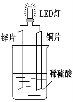
某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是(填序号)。
(2)其他条件相同情况下,产生气泡的速率比单一锌片(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向(填“变”或“不变”)。
(3)如果把硫酸换成硫酸铜溶液,猜测(填“锌片”或“铜片”)变厚,原因是(用电极方程式表示)。实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为mol。
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱。
序号 | 甲 | 乙 | 丙 |
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据以上现象,判断四种金属活泼性由强到弱的顺序是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,A容器中的氧气和B容器中的氨气所含的原子个数相同时,则A、B两容器中气体体积之比为( )
A. 1:2 B. 2:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:
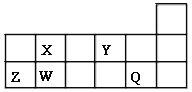
(1)W在周期表中的位置是___________,Y、Z的离子半径由大到小的顺序为___________ (用元素符号表示);由X与氢元素组成四原子化合物的电子式为__________。
(2)下列说法正确的是____________。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80 mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作Ⅱ:再加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:
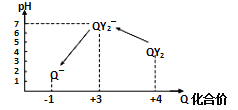
①操作Ⅰ中反应的离子方程式是_________________________。
②确定操作Ⅱ完全反应的现象是_________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是______________________。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了1.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______________mg·L-1(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2mol H2完全燃烧生成水蒸气放出热量484kJ,且1molH﹣H键断裂时吸收热量为436kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则O2中1mol O=O键完全断裂时吸收热量( )
A.496 kJ
B.188 kJ
C.557 kJ
D.920kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)![]() 2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )

X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】贞丰中学化学兴趣小组甲、乙、丙、三名同学探究化学反应速率的影响因素,实验如下。
(1)甲同学探究“温度对化学反应速率的影响”。取两支试管A、B,分别加入25mL 1mol/L 的HNO3溶液和0.5g相同的铜片,将A放在常温下,将B放在60摄氏度的水浴中。观察实验现象:铜片最先完全溶解的是 (填A或B)。据此得出结论 ,温度影响反应速率的本质原因 ,
(2)乙同学取两支试管C、D,各加入4mL0.01mol/LKMnO4酸性溶液,C中加入2mL0.1mol/LH2C2O4溶液,D中加入2mL0.2mol/LH2C2O4溶液,观察到的现象是 ,据此乙同学得出“反应物浓度越大,反应速率越快”的结论。写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 ,
(3)丙同学探究0.1mol/L FeCl3溶液对10%的H2O2溶液分解速率的影响,请你为她设计实验。
实验原理: (用化学方程式表示)。
实验操作: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,有学者探究用电解法制备的效率,装置如图,试写出其阳极电极反应式__________________;

(2)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
放电时,正极的电极反应式为_________;充电时,Pb电极应该连接在外接电饭的___(填“正极”或“负极”)。
(3)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJ/mol
CH3CH2OH(g)+H2O(g) △H=-256.1kJ/mol
己知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式为:___________。
(4)饮用水中的NO3-主要来自NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com