
【题目】贞丰中学化学兴趣小组甲、乙、丙、三名同学探究化学反应速率的影响因素,实验如下。
(1)甲同学探究“温度对化学反应速率的影响”。取两支试管A、B,分别加入25mL 1mol/L 的HNO3溶液和0.5g相同的铜片,将A放在常温下,将B放在60摄氏度的水浴中。观察实验现象:铜片最先完全溶解的是 (填A或B)。据此得出结论 ,温度影响反应速率的本质原因 ,
(2)乙同学取两支试管C、D,各加入4mL0.01mol/LKMnO4酸性溶液,C中加入2mL0.1mol/LH2C2O4溶液,D中加入2mL0.2mol/LH2C2O4溶液,观察到的现象是 ,据此乙同学得出“反应物浓度越大,反应速率越快”的结论。写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 ,
(3)丙同学探究0.1mol/L FeCl3溶液对10%的H2O2溶液分解速率的影响,请你为她设计实验。
实验原理: (用化学方程式表示)。
实验操作: 。
【答案】(1)B 温度越高,化学反应速率越快
升高温度,活化分子百分比增大,单位时间内有效碰撞次数增大,化学反应速率加快。
(2)D中褪色时间比C中褪色时间短
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(3)2H2O2![]() 2H2O+O2↑
2H2O+O2↑
取两支试管E、F,分别加入10mL10%的H2O2溶液,在E中滴加两滴 FeCl3溶液,F中不加。观察E、F中产生气泡的速率。
【解析】
试题分析:影响化学反应速率的因素有温度,浓度,压强,催化剂,反应物的颗粒大小等因素
(1)温度越高,化学反应速率越快,其本质原因就是升高温度,活化分子百分比增大,单位时间内有效碰撞次数增大,化学反应速率加快,因此本题B中反应速率更快一些
(2)反应物浓度越大,化学反应速率越快,在此反应中使用相同体积相同浓度紫色高锰酸钾的溶液,化学反应速率的快慢可用溶液中高锰酸钾反应情况来观察反应的快慢,故D中褪色时间比C中褪色时间短 ,可用于做为反应速率快慢的依据;
(3)FeCl3在双氧水的分解反应中做催化剂,此处可做对比实验处理,如取取两支试管E、F,分别加入10mL10%的H2O2溶液,在E中滴加两滴 FeCl3溶液,F中不加。观察E、F中产生气泡的速率。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】关于胶体和溶液的叙述中正确的是
A. 胶体带电荷,而溶液呈电中性
B. 胶体加入电解质可产生沉淀,而溶液不能
C. 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系
D. 胶体和溶液都能够产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+![]() O2(g)==CO2(g);△H=-283.0kJ/mol
O2(g)==CO2(g);△H=-283.0kJ/mol
B.C(s)+![]() O2(g)==CO(g);△H=-110.5kJ/mol
O2(g)==CO(g);△H=-110.5kJ/mol
C.H2(g)+![]() O2(g)==H2O(g);△H=-241.8kJ/mol
O2(g)==H2O(g);△H=-241.8kJ/mol
D.2C8H18(l)+25O2(g)==16CO2(g)+18H2O(l);△H=-11036kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳被广泛应用于冶金工业和电子工业。
(1)己知CO的燃烧热为283kJ/mol,请写出体现CO燃烧热的热化学方程式___________。
(2)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol
CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s)△H=bkJ/mol
请写出CO直接将Fe2O3还原为Fe的热化学方程式:____________(用含a,b的代数式表示△H的数值)。
(3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图所示。这种传感器利用燃料电池原理,则该电池的负极反应式为_________。
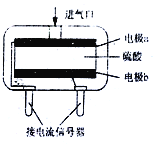
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 石灰石溶于稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O
B. 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
C. 氧化镁与稀硫酸:MgO+2H+=Mg2++H2O
D. 常温下,将铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是 ,基态D原子价电子的轨道表达式为 。
(2)DA2分子的VSEPR模型是 。H2A比H2D熔沸点高得多的原因是 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
① C2Cl6属于 晶体(填晶体类型),其中C原子的杂化轨道类型为 杂化。
② [C(OH)4]-中存在的化学键有 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是 。
(5)B、C的氟化物晶格能分别是2957 kJ·mol-1、5492 kJ·mol-1,二者相差很大的原因是____________。

(6)D与E所形成化合物晶体的晶胞如图所示。
① 在该晶胞中,E的配位数为______________。
② 原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(![]() ,0,
,0,![]() );c为(
);c为(![]() ,
,![]() ,0)。则d原子的坐标参数为_________________。
,0)。则d原子的坐标参数为_________________。
③ 已知该晶胞的密度为ρ g/cm3,则其中两个D原子之间的距离为_________ pm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com