
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)![]() 2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )

X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)制备铁红(Fe2O3)的生产流程如下:
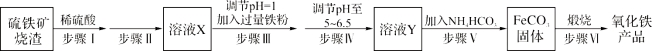
试回答下列问题:
(1)步骤Ⅰ所得溶液中铁元素的化合价是 。
(2)实验室中实现步骤Ⅱ中分离操作需要的仪器有 、铁架台、玻璃棒、烧杯。
(3)步骤Ⅲ中发生的离子方程式 ,向反应后的溶液中加入试剂 ,当观察到 说明步骤Ⅲ已经进行完全。
(4)步骤Ⅳ中不能选用试剂 调节溶液的pH(填字母编号)。
a.FeO固体 b.氢氧化钠溶液 c.Fe2O3固体 d.氨水
(5)室温下FeCO3达到溶解平衡时溶液pH=8.5,c(Fe2+)=1.2×10-6 mol·L-1。则FeCO3固体产物中 (选填“有”或“无”)Fe(OH)2。(已知:Ksp[Fe(OH)2]=4.8×10-16)
(6)步骤Ⅵ中发生反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是
A.呈弱酸性,使石蕊试液显浅红色 B.分子中的13个原子有可能处于同一平面
C.可以和NaHCO3溶液反应产生气体 D.能与FeCl3溶液反应生成紫色沉淀a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳被广泛应用于冶金工业和电子工业。
(1)己知CO的燃烧热为283kJ/mol,请写出体现CO燃烧热的热化学方程式___________。
(2)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol
CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s)△H=bkJ/mol
请写出CO直接将Fe2O3还原为Fe的热化学方程式:____________(用含a,b的代数式表示△H的数值)。
(3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图所示。这种传感器利用燃料电池原理,则该电池的负极反应式为_________。
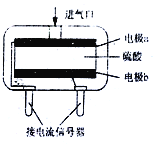
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
A. 第三周期VIII族,P区
B. 第三周期VB族,ds区
C. 第四周期VIII族,d区
D. 第四周期VB族, f区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制500 mL 0.2 mol/LNaOH溶液需要的NaOH质量是多少?
(2)取上述溶液20 mL稀释成100 mL后其物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)步骤Ⅰ中所用的试剂是______________。
(2)步骤Ⅲ中反应的离子方程式是_________________。
(3)步骤Ⅴ可选用的试剂是__________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤Ⅵ的实验操作是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com