
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
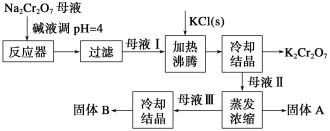

(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
【答案】除去Fe3+ 低温下K2Cr2O7溶解度远小于其它组分,温度的降低K2Cr2O7溶解度明显减小NaClⅡCr2O72-+6I-+14H+=2Cr3++3I2+7H2O94.08%
【解析】
(1)根据题目信息,母液中含有少量的Fe3+,加碱液的目的是除去Fe3+,故答案为:除去Fe3+;
(2)根据温度与溶解度的关系,K2Cr2O7的溶解度受温度的影响较大,低温时K2Cr2O7的溶解度远小于其他组分,且温度降低,K2Cr2O7的溶解度受温度的影响较大,故答案为:低温下K2Cr2O7溶解度远小于其它组分,温度的降低K2Cr2O7溶解度明显减小;
(3)母液I中加入KCl,发生Na2Cr2O7+KCl=K2Cr2O7+NaCl,采用冷却降温得到K2Cr2O7固体,即母液II中含有大量的NaCl,因此蒸发浓缩得到的固体是NaCl;冷却结晶中有大量的K2Cr2O7析出,但溶液中含有少量的K2Cr2O7,蒸发浓缩时,NaCl表面附着一部分K2Cr2O7,为了提高产率又可使能耗降低,因此需要把洗涤液转移到母液II中,达到类似富集的目的,故答案为:NaCl、Ⅱ;
(4)①根据操作,得出K2Cr2O7作氧化剂,本身被还原成Cr3+,I-被氧化成I2,因此有Cr2O72-+I-→Cr3++I2,然后采用化合价升降法、原子守恒配平即可,离子方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②根据离子方程式,得出关系式为Cr2O72-~3I2~6S2O32-,则求出样品中K2Cr2O7的质量为
0.04L×0.12mol/L÷6×![]() ×294g/mol=2.352g,纯度为2.352/2.500×100%=94.08%,故答案为:94.08%。
×294g/mol=2.352g,纯度为2.352/2.500×100%=94.08%,故答案为:94.08%。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素;W原子的质子数等于Y、Z原子最外层电子数之和;Y与X形成的分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)由上述元素组成的4核10电子的离子的电子式_____________;
(2)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式 ________________;
(3)由X、Y、Z所形成的常见离子化合物是____________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________;X与W形成的化合物与水反应时,离子方程式为________________;
(4)用电子式表示W与Z形成W2Z化合物的过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G 七种原子序数依次增大的元素,其中前六种属于短周期主族元素。A与 B可构成三核10电子的分子;E 原子的核外电子数是 B 原子的核内质子数的2倍;C、D、F同周期,且它们的最高价氧化物的水化物两两之间相互发生复分解反应;G的一种氧化物常作红色油漆的颜料。
(1)F 形成的单核阴离子的电子式为__________________。
(2)M是由 A、B、C组成的常见化合物,M中的化学键类型有______________。
(3)向C、D的最高价氧化物的水化物相互反应后的溶液中缓慢滴加盐酸至过量,产生的现象是___,反应的离子方程式为______,G 的单质与水蒸气反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:______,E元素位于元素周期表______。
(2)A、B、C三种元素的第一电离能最大的是______![]() 用元素符号表示
用元素符号表示![]() 。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______
。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______ ![]() 写化学式
写化学式![]() 。
。
(3)D可形成化合物![]() 。
。
![]() 中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
![]() 个
个![]() 中含有的
中含有的![]() 键数目为______个。
键数目为______个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_____________![]() 填化学式
填化学式![]() 为非极性分子,另一种化合物的电子式为_____________。
为非极性分子,另一种化合物的电子式为_____________。
(5)![]() 离子能与
离子能与![]() 离子形成ESCN沉淀。
离子形成ESCN沉淀。![]() 离子对应的酸有硫氰酸
离子对应的酸有硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸沸点更高的是______(填名称),原因是__________。
,这两种酸沸点更高的是______(填名称),原因是__________。
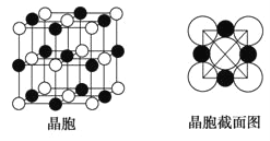
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个![]() 最近的
最近的![]() 有______个,距离一个
有______个,距离一个![]() 最近的
最近的![]() 围成的图形是_____________
围成的图形是_____________![]() 写名称
写名称![]() 。若晶体密度为
。若晶体密度为![]()
![]() ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用![]() 表示,则
表示,则![]() 的半径为____________________
的半径为____________________![]() 用含
用含![]() 与
与![]() 的式子表达
的式子表达![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何除去下列物质中的杂质,请在相关栏目内填表
含杂质物质 | 除杂试剂或方法 | 有关反应的化学方程式 |
(1)NO(NO2 ) | ______ | ______ |
(2)SiO2(CaCO3) | ______ | ______ |
(3)SO2 (HCl ) | ______ | ______ |
(4)Na2CO3固体(NaHCO3) | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 mol Fe溶于过量硝酸,电子转移数为2NA
B. 2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol 的11B中,含有0.6NA个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机分子中,所有的原子不可能处于同一平面的是( )
A. CH2==CH2 B. CH2==CH—CH==CH2
C. CH2==C(CH3)—CH==CH2 D. CH2==CH—C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的观点出发,由铜制取硝酸铜最适宜的方法是
A. Cu与浓HNO3―→Cu(NO3)2
B. Cu与稀HNO3―→Cu(NO3)2
C. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D. Cu+AgNO3―→Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com