
【题目】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素;W原子的质子数等于Y、Z原子最外层电子数之和;Y与X形成的分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)由上述元素组成的4核10电子的离子的电子式_____________;
(2)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式 ________________;
(3)由X、Y、Z所形成的常见离子化合物是____________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________;X与W形成的化合物与水反应时,离子方程式为________________;
(4)用电子式表示W与Z形成W2Z化合物的过程:__________________。
【答案】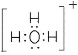 2H2O2
2H2O2![]() 2H2O+O2↑ NH4NO3 NH4++OH-
2H2O+O2↑ NH4NO3 NH4++OH-![]() NH3↑+H2O NaH + H2O = Na+ + OH- + H2↑
NH3↑+H2O NaH + H2O = Na+ + OH- + H2↑ ![]()
【解析】
X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,则X为H元素;Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y、Z为同周期的相邻元素,则Y为N元素,Y与X形成的NH3分子中有3个共价键;X、W同主族,则W原子的质子数等于Y、Z原子最外层电子数之和,则W为Na,据此分析解答。
根据上述分析,X为H元素,Y为N元素,Z为O元素,W为Na元素。
(1)由上述元素组成的4核10电子的离子为H3O+,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)H与O可分别形成10电子和18电子的分子,分别为H2O、H2O2,过氧化氢在二氧化锰作催化剂条件下分解为水与氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(3)由X、Y、Z所形成的常见离子化合物是NH4NO3,W的最高氧化物的水化物为NaOH,二者反应的离子方程式为:NH4++OH- ![]() NH3↑+H2O;X与W形成的化合物是NaH,氢化钠和水反应生成氢氧化钠和氢气,反应离子方程式为:NaH+H2O=Na++OH-+H2↑,故答案为:NH4NO3;NH4++OH-
NH3↑+H2O;X与W形成的化合物是NaH,氢化钠和水反应生成氢氧化钠和氢气,反应离子方程式为:NaH+H2O=Na++OH-+H2↑,故答案为:NH4NO3;NH4++OH- ![]() NH3↑+H2O;NaH+H2O=Na++OH-+H2↑;
NH3↑+H2O;NaH+H2O=Na++OH-+H2↑;
(4)用电子式表示W与Z形成Na2O的过程为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】将一块金属钠投入足量的下列溶液中,既能生成气体,又能生成白色沉淀的是( )
A.稀硫酸B.Ba(OH)2稀溶液C.MgCl2溶液D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为_____________B池为____________
(2)铜极为__________极,电极反应式为______________________________
石墨棒C1为______极,电极反应式为_______________________________,检验该产物的简单方法是____________________________________________________
石墨棒C2附近发生的实验现象为____________________________________
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少了______________g。CuSO4溶液的质量增加了_________________________g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:

(1)A元素的名称为_____,D离子的结构示意图为______
(2)C在周期表中的位置为_________
(3)B、C的气态氢化物的稳定性关系为______(填化学式)
(4)以上五种元素所形成的的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
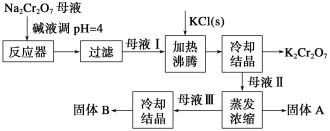

(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com