
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为_____________B池为____________
(2)铜极为__________极,电极反应式为______________________________
石墨棒C1为______极,电极反应式为_______________________________,检验该产物的简单方法是____________________________________________________
石墨棒C2附近发生的实验现象为____________________________________
(3)当C2极析出224mL气体(标准状态)时,锌的质量减少了______________g。CuSO4溶液的质量增加了_________________________g 。
【答案】 原电池 电解池 正 Cu2++2e-=Cu 阳 2Cl--2e-=Cl2↑ 湿润的淀粉KI试纸变蓝 气泡,溶液变红 0.65g 0.01g
【解析】(1)有外加电源的是电解池,没有外加电源的是原电池或者根据原电池和电解池的构成条件来回答;(2)原电池中活泼金属做负极,发生失电子的氧化反应;(3)和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;(4)根据电子守恒定律来计算回答。
(1)由图示可知A池是锌铜原电池,做为电源电解B池,B是电解池,连接Zn负极的C2电极为阴极,连接Cu正极的C1电极为阳极。故答案为:原电池 ;电解池;
(2)A池为原电池:Zn + Cu2+==Zn2++ Cu
负极:Zn-2e-=Zn2+正极:Cu2++2e-=Cu
B池为电解池:2KCl+2H2O =2KOH+H2↑+Cl2↑
阴极:2H++2e-=H2↑;阳极:2Cl—+2e—= Cl2↑
阳极产生氯气,检验氯气的简易方法是:湿润的淀粉KI试纸变蓝;在阴极由于氢离子的放电,导致溶液呈碱性,酚酞呈红色。故答案为:气泡,溶液变红;
(3)224ml气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知,消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。原电池中每进入1 molZn而析出1 molCu,故溶液的质量增加65g-64g =1 g
H2 ~ 2e- ~△m
1mol 1 g
0.01mol 0.01g
因此,本题答案为:0.65g ; 0.01g;


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl+2H2O![]() Cl2↑+2OH-+ H2↑
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些烷烃的燃烧热如下表:
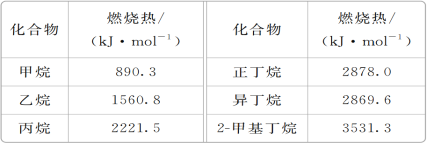
下列表达正确的是( )
A. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1
B. 稳定性:正丁烷>异丁烷
C. 正戊烷的燃烧热大于3531.3 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~在表中的位置,请回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素,化学性质最稳定的是________,金属性最强的是__________,非金属性最强的是_______(写编号);最高价氧化物的水化物的酸性最强的是(写化学式)___________。
(2)④、⑩的气态氢化物中的稳定性强些的是_______。(填化学式)
(3)④、⑥、⑦、⑩元素形成的离子,离子半径的大小顺序是 ____________(填化学式)
(4)写出一种由①④组成且含有非极性键的物质的电子式_____________。
(5)实验室制取气体的离子方程式为_____________________________
(6)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑧非金属性强弱的一个常见反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素;W原子的质子数等于Y、Z原子最外层电子数之和;Y与X形成的分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)由上述元素组成的4核10电子的离子的电子式_____________;
(2)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式 ________________;
(3)由X、Y、Z所形成的常见离子化合物是____________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________;X与W形成的化合物与水反应时,离子方程式为________________;
(4)用电子式表示W与Z形成W2Z化合物的过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D. ![]() 原子核内有个51个中子,核外有 41个电子
原子核内有个51个中子,核外有 41个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的外围电子排布式:______,E元素位于元素周期表______。
(2)A、B、C三种元素的第一电离能最大的是______![]() 用元素符号表示
用元素符号表示![]() 。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______
。这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______ ![]() 写化学式
写化学式![]() 。
。
(3)D可形成化合物![]() 。
。
![]() 中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
中配位体的VSEPR模型名称是_____________。该化合物中阴离子的中心原子的轨道杂化类型为_____________。
![]() 个
个![]() 中含有的
中含有的![]() 键数目为______个。
键数目为______个。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_____________![]() 填化学式
填化学式![]() 为非极性分子,另一种化合物的电子式为_____________。
为非极性分子,另一种化合物的电子式为_____________。
(5)![]() 离子能与
离子能与![]() 离子形成ESCN沉淀。
离子形成ESCN沉淀。![]() 离子对应的酸有硫氰酸
离子对应的酸有硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸沸点更高的是______(填名称),原因是__________。
,这两种酸沸点更高的是______(填名称),原因是__________。
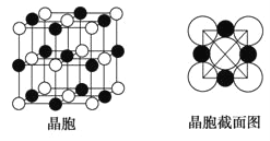
(6)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为A、C形成化合物的晶胞结构图以及晶胞的截面图,晶胞中距离一个![]() 最近的
最近的![]() 有______个,距离一个
有______个,距离一个![]() 最近的
最近的![]() 围成的图形是_____________
围成的图形是_____________![]() 写名称
写名称![]() 。若晶体密度为
。若晶体密度为![]()
![]() ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用![]() 表示,则
表示,则![]() 的半径为____________________
的半径为____________________![]() 用含
用含![]() 与
与![]() 的式子表达
的式子表达![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com