
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:

(1)A元素的名称为_____,D离子的结构示意图为______
(2)C在周期表中的位置为_________
(3)B、C的气态氢化物的稳定性关系为______(填化学式)
(4)以上五种元素所形成的的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式_________
【答案】氧 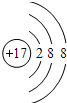 第三周期ⅥA族 PH3<H2S Al(OH)3+NaOH=Na[Al(OH)4]
第三周期ⅥA族 PH3<H2S Al(OH)3+NaOH=Na[Al(OH)4]
【解析】
A、B、C、D、E五种短周期元素,由位置图可以知道,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,计算得出x=16,故C为S,A为O,B为P,D为Cl;1mol E单质与足量酸作用,在标准状况下能产生33.6LH2,设E的化合价为y,根据电子转移守恒:1mol![]() y=
y=![]() 1,计算得出y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,然后利用元素及其单质、化合物的性质来解答。
1,计算得出y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,然后利用元素及其单质、化合物的性质来解答。
根据以上分析,A为O;B为P;C为S;D为Cl;E为Al,
(1)O元素的名称为氧,Cl-的结构示意图为 ,
,
因此,本题正确答案是:氧; ;
;
(2)S在周期表中的位置为第三周期ⅥA族,
因此,本题正确答案是:第三周期ⅥA族;
(3)元素的非金属性越强,其气态氢化物越稳定,P、S的非金属性P<S,则气态氢化物的稳定性关系为PH3<H2S,
因此,本题正确答案是:PH3<H2S;
(4)Al的最高价氧化物对应的水化物氢氧化铝是两性氢氧化物,既能与强酸反应又能与强碱反应,反应的化学方程式为Al(OH)3+NaOH=Na[Al(OH)4],
因此,本题正确答案是:Al(OH)3+NaOH=Na[Al(OH)4]。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B. 放电时电池内部Li+向负极移动
C. 充电过程中,电池正极材料的质量增加
D. 可加入硫酸以提高电解质的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~在表中的位置,请回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | ⑤ | ||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素,化学性质最稳定的是________,金属性最强的是__________,非金属性最强的是_______(写编号);最高价氧化物的水化物的酸性最强的是(写化学式)___________。
(2)④、⑩的气态氢化物中的稳定性强些的是_______。(填化学式)
(3)④、⑥、⑦、⑩元素形成的离子,离子半径的大小顺序是 ____________(填化学式)
(4)写出一种由①④组成且含有非极性键的物质的电子式_____________。
(5)实验室制取气体的离子方程式为_____________________________
(6)利用较强酸能制出较弱酸的原理,写出一个能证明②和⑧非金属性强弱的一个常见反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素;W原子的质子数等于Y、Z原子最外层电子数之和;Y与X形成的分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)由上述元素组成的4核10电子的离子的电子式_____________;
(2)X与Z可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式 ________________;
(3)由X、Y、Z所形成的常见离子化合物是____________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________;X与W形成的化合物与水反应时,离子方程式为________________;
(4)用电子式表示W与Z形成W2Z化合物的过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
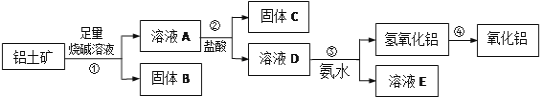
(1)固体B的颜色为_____;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___、____
(3)第③步中,生成氢氧化铝的离子方程式是______,若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D. ![]() 原子核内有个51个中子,核外有 41个电子
原子核内有个51个中子,核外有 41个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 1 mol Fe溶于过量硝酸,电子转移数为2NA
B. 2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D. 0.1 mol 的11B中,含有0.6NA个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com