
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
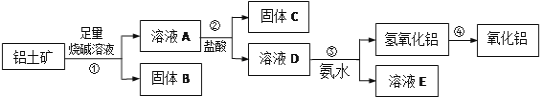
(1)固体B的颜色为_____;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___、____
(3)第③步中,生成氢氧化铝的离子方程式是______,若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____(填化学式)。
【答案】红棕色 Al2O3+2OH-+3H2O=2[Al(OH)4]- SiO2+2OH-=SiO32-+H2O Al3++3NH3H2O=Al(OH)3↓+3NH4+ Al(OH)3、H2SiO3 CO
【解析】
向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶于强酸又溶于强碱。只有Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于盐酸。则在①得到滤液中含有偏铝酸根离子、硅酸根离子,加入过量的盐酸后生成硅酸和氯化铝,氯化铝溶液中滴入氨水生成氢氧化铝,氢氧化铝受热分解,生成氧化铝,由此分析解答。
(1)根据以上分析固体B为Fe2O3,Fe2O3颜色为红棕色,
因此,本题正确答案是:红棕色;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱。Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于盐酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH-+3H2O=2[Al(OH)4]-、SiO2+2OH-=SiO32-+H2O,
因此,本题正确答案是:Al2O3+2OH-+3H2O=2[Al(OH)4]-;SiO2+2OH-=SiO32-+H2O;
(3)试剂③为氨水,将铝离子转化为氢氧化铝沉淀.离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;若往A溶液中通入足量CO2,硅酸根离子和偏铝酸根离子反应生成硅酸和氢氧化铝,
因此,本题正确答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+ ;Al(OH)3、H2SiO3 ;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5mol碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,
因此,本题正确答案是:CO。


科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2 ↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号);H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(2)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4-+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为:______________________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )

A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:

(1)A元素的名称为_____,D离子的结构示意图为______
(2)C在周期表中的位置为_________
(3)B、C的气态氢化物的稳定性关系为______(填化学式)
(4)以上五种元素所形成的的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 16 g O2和O3的混合气体中含有的分子数为0.5NA
B. 0.3 mol AgNO3受热完全分解(2AgNO3===2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C. 100 mL 12 mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞,则下列说法中正确的是

A. 超氧化钾的化学式为KO2
B. 每个晶胞中含有8个K+和4个![]()
C. 晶体中与每个K+距离最近的K+有8个![]()
D. 晶体中0价氧原子和-2价氧原子个数比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对钠在CO2气体中燃烧进行了下列实验:
操作过程 | 实验现象 |
将干燥纯净的CO2缓缓通过放有钠的干燥玻璃管(已排尽空气)中,加热 | 钠燃烧,火焰为黄色 |
反应后冷却 | 管壁附有黑色颗粒和白色物质 |
(1)若钠着火,可以选用的灭火物质是__________。
A.水 B.泡沫灭火剂 C.干沙土 D.二氧化碳
(2)该小组同学对管壁的白色物质的成分进行讨论并提出假设:
Ⅰ.白色物质可能是Na2O; Ⅱ.白色物质可能是Na2CO3; Ⅲ.白色物质还可能是__________
(3)为确定该白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液 | 出现白色沉淀 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
①通过对上述实验的分析,你认为上述三个假设中,__________成立。
②该白色物质的水溶液pH>7,用离子方程式表示其原因:___________________。
③钠在CO2中燃烧的化学方程式为______;每生成1mol氧化产物,转移的电子数目为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com