
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N≡N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1,逆反应速率v(NH3)=0.4 mol·(L·min)-1
A.全部B.②③④⑤⑥⑦
C.②③④⑤⑦D.③④⑤⑥⑦
【答案】C
【解析】
①一个N≡N断裂的同时,有3个H-H键断裂,表示的都是正反应速率,无法判断正逆反应速率是否相等,故①错误;
②一个N≡N键断裂的同时,有6个N-H键断裂,正逆反应速率相等,达到了平衡状态,故②正确;
③反应两边气体的质量不变,气体的体积不相等,混合气体平均相对分子质量不再改变,说明正逆反应速率相等,达到了平衡状态,故③正确;
④保持其它条件不变时,体系压强不再改变,反应方程式两边气体的体积不相等,压强不变,说明正逆反应速率相等,达到了平衡状态,故④正确;
⑤NH3、N2、H2的体积分数都不再改变,说明各组分的浓度不变,达到了平衡状态,故⑤正确;
⑥恒温恒容时,混合气体的密度保持不变,由于气体的质量不变,容器的容积不变,所以气体的密度始终不变,故密度无法判断是否达到平衡状态,故⑥错误;
⑦正反应速率v(H2)=0.6mol/(Lmin),逆反应速率v(NH3)=0.4mol/(Lmin),说明正逆反应速率相等,达到了平衡状态,故⑦正确;
答案选项C。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=(10-14+10-10)/2
B.常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4
C.氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小
D.常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B.[实验化学]
丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。

(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤2中,上图所示的装置中仪器A的名称是______;蒸馏烧瓶中加入碎瓷片的目的是______。
(3)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是____;分离出有机相的操作名称为____。
(4)步骤4中,蒸馏时不能用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 的说法正确的是
的说法正确的是
A. 最多有7个原子在同一直线上 B. 最多有7个碳原子在同一直线上
C. 所有碳原子可能都在同一平面上 D. 最多有18个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
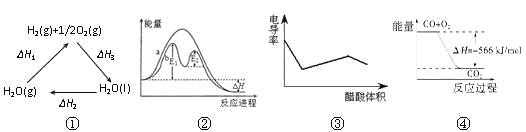
A.图①中△H1=△H2+△H3
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的反应过程和能量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是___,E2D2的电子式为___。
(2)AFD的结构式为___,BD2的电子式为___。
(3)EDA的电子式为___,AF的电子式为___。
(4)B元素形成的化合物种类繁多的原因可能是(填序号)___。
①碳原子之间成键方式多样化,碳碳之间可以单键、双键或者叁键
②同分异构现象的普遍存在
③碳碳之间可以通过共价键彼此结合成链状或者环状
(5)元素D、E、F形成的简单离子的半径由大到小为__(用离子符号表示)。
(6)用电子式表示E与F形成化合物的过程___。
(7)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
2SO3(g) △H =-Q kJ·mol1(Q>0),则下列说法正确的是( )
A.2mol SO2(g)和1mol O2(g)所具有的总能量小于2mol SO3(g)所具有的能量
B.将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小
D.将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com