
����Ŀ������A��H�������ʴ�������ͼ��ʾ��ת����ϵ(��Ӧ���������ֲ���δ���)����֪A�����Σ�B��ʹƷ����Һ��ɫ��G�Ǻ���ɫ���塣�Իش��������⣺
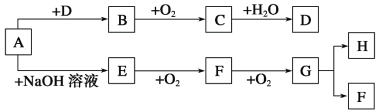
(1)д�����и����ʵĻ�ѧʽ��A________________��B________________��
(2)��Ҫ��д�����з�Ӧ���йط���ʽ
E��F��Ӧ�Ļ�ѧ����ʽ_____________________________________________________��
G��H��Ӧ�����ӷ���ʽ_____________________________________________________��
(3)д��H��Ũ��Һ��ľ̿��Ӧ�Ļ�ѧ����ʽ_______________________________________��
(4)����D�������ӵķ�����___________________________________________________��
���𰸡�(NH4)2SO3 SO2 4NH3+5O2![]() 4NO+6H2O 3NO2+H2O=2H++2NO3-+NO C+4HNO(Ũ)
4NO+6H2O 3NO2+H2O=2H++2NO3-+NO C+4HNO(Ũ)![]() 4NO2��+CO2��+2H2O ȡ��������Һ���Թ��У�������ϡ�����ữ��δ���������ɣ��ټ�������BaCl2��Һ��������ְ�ɫ��������֤������Һ�к���SO42-
4NO2��+CO2��+2H2O ȡ��������Һ���Թ��У�������ϡ�����ữ��δ���������ɣ��ټ�������BaCl2��Һ��������ְ�ɫ��������֤������Һ�к���SO42-
��������
G�Ǻ���ɫ���壬����NO2��F��������Ӧ���ɶ�������������F��NO��A�����Σ����������Ʒ�Ӧ����E��E��������Ӧ����NO����E��NH3��A����Σ�����������ij�����ʷ�Ӧ��������NO��H�����Ǻ�ˮ��Ӧ���������NO������H�����B��ʹƷ����Һ��ɫ����B�ܺ�������Ӧ����C������B��SO2��C��SO3��A������������Σ���Ӧ�������ɶ�����������A��(NH4)2SO3�����������ˮ��Ӧ�������ᣬ��D�����ᣬ�ݴ˷������
(1)ͨ�����Ϸ���֪��A��(NH4)2SO3��B��SO2��
(2)���¡����������£�������������Ӧ����һ��������ˮ����Ӧ����ʽΪ��4NH3+5O2![]() 4NO+6H2O������������ˮ��Ӧ���������һ�����������ӷ���ʽΪ��3NO2+H2O=2H++2NO3-+NO��
4NO+6H2O������������ˮ��Ӧ���������һ�����������ӷ���ʽΪ��3NO2+H2O=2H++2NO3-+NO��
(3)���������£�̼��Ũ���ᷴӦ���ɶ���������������̼��ˮ����Ӧ����ʽΪ��C+4HNO3(Ũ)![]() 4NO2��+CO2��+2H2O��
4NO2��+CO2��+2H2O��
(4)D�к�����������ӣ���������ӵļ��鷽���ǣ�ȡ��������Һ���Թ��У�������ϡ�����ữ��δ���������ɣ��ټ�������BaCl2��Һ��������ְ�ɫ��������֤������Һ�к���SO42-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��þ-����ȼ�ϵ�ع���ԭ��ʾ��ͼ������ܷ�ӦΪ2Mg��O2��2H2O=2Mg(OH)2�������йظõ�ص�˵����ȷ���ǣ� ��
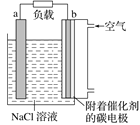
A.a��Ϊ������������ԭ��Ӧ
B.b�缫�ϵ缫��Ӧ��O2��2H2O��4e-=4OH-
C.����ʱ������b�������·����a��
D.��װ��ʵ���˵���ת���ɻ�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����

A. ͼ����CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
B. ͼ����������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2 )�淴Ӧʱ��仯��������˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
C. ͼ������������0.1000 mol��L1NaOH��Һ�ζ�20.00 mL 0.1000 mol��L1ijһԪ��HX�ĵζ�������˵��HX��һԪǿ��
D. ͼ������������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+ )��c(SO42)�Ĺ�ϵ������˵����Һ��c(SO42 )Խ��c(Ba2+ )ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������������������������������ʱ����������ʯī����
B. ��������ĵ���ˮ��Һ�У��ȼ�����������Һ���ټӵ�ˮ����������Ƿ�ˮ����ȫ
C. ��Ӧ3Si(s)+2N2(g)=Si3N4(s)���Է����У���÷�Ӧ����H<0
D. ��֪BaSO4��Ksp= (Ba2+ )��c(SO42-)������BaSO4����������Һ���ܽ�ﵽ����ʱ��c(Ba2+)=c(SO42-)=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ʳ�������ˮ�еĵ�Ԫ�ض���NH![]() ��NH3��H2O����ʽ���ڣ��÷�ˮ�Ĵ����������£�
��NH3��H2O����ʽ���ڣ��÷�ˮ�Ĵ����������£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)����������NaOH��Һ������pH��9��������30����ͨ���������ϳ������ա�
�����ӷ���ʽ��ʾ��NaOH��Һ�����ã�______________________________________��
(2)�����������������õ������£�NH![]() ����������Ӧ��������NO
����������Ӧ��������NO![]() ��������Ӧ�������仯ʾ��ͼ���£�
��������Ӧ�������仯ʾ��ͼ���£�

��һ����Ӧ��________��Ӧ(ѡ��������������������)���ж�������________��
(3)��������һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OHת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�����̶����ܱ������з������淴Ӧ4HCl��g��+O2��g����2H2O��g��+2Cl2��g��������˵����Ӧ�Ѿ��ﵽƽ��״̬���ǣ�������
A.���������ܶȱ��ֲ���
B.��������ƽ����Է����������ֲ���
C.�Ͽ�4molH��Cl����ͬʱ������4molH��O��
D.HCl��O2��H2O��Cl2������������ʵ���֮��Ϊ4��1��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��Ϊǰ20��Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ����ͼ��ʾ������˵����������

A. Z��M������������Ӧˮ�����Ϊǿ��
B. X��Y��Z����Ԫ����ɵĻ�����������ᡢ�����
C. �����Ӱ뾶��M �� Y �� Q
D. ���RM2ˮ��Һ�ɵõ�R����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͨѶ�ǹ��ά�����źŵ�һ��ͨѶ�ֶΣ��ϳɹ��ά��������(һ����Ϳ��)�Ĺ����������£�

�ش��������⣺
(1)��ӦI�Ļ�ѧ����ʽΪ2C+SiO2![]() Si+2CO�������л�ԭ��Ϊ_______________������Si�����ڱ���λ��_______________���÷�Ӧ�漰�ĸ���Ӧ������C+SiO2
Si+2CO�������л�ԭ��Ϊ_______________������Si�����ڱ���λ��_______________���÷�Ӧ�漰�ĸ���Ӧ������C+SiO2![]() Si+CO2��(̼����)��__________________________________(̼����)��
Si+CO2��(̼����)��__________________________________(̼����)��
(2)����Ӧ�����õ����Ȼ����Ʒ���������������£�
������� | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
�������� | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
�е�/�� | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
ͼ��������X��������Ϊ______________________��PCl3�ĵ���ʽΪ________________��
(3)��ӦIV�Ļ�ѧ����ʽΪSiCl4+4NH3![]() Si3N4+12HCl������һ2L�����ܱ�������Ͷ��1molSiCl4��1molNH3��6min��Ӧ��ȫ����0��6min�ڣ�HCl��ƽ����Ӧ����Ϊ__________mol/(L��min)����ӦIII����IV������������ͬ����ӦIII��ѧ����ʽΪ__________________����ӦIII�е�ԭ����H2��O2�ڼ��������¿ɹ���ȼ�ϵ�أ���������Ӧ�ĵ缫����ʽΪ__________________��
Si3N4+12HCl������һ2L�����ܱ�������Ͷ��1molSiCl4��1molNH3��6min��Ӧ��ȫ����0��6min�ڣ�HCl��ƽ����Ӧ����Ϊ__________mol/(L��min)����ӦIII����IV������������ͬ����ӦIII��ѧ����ʽΪ__________________����ӦIII�е�ԭ����H2��O2�ڼ��������¿ɹ���ȼ�ϵ�أ���������Ӧ�ĵ缫����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڿ��淴Ӧ��A(g)+3B(g) ![]() 2C(g) ��H <0������������ȷ��
2C(g) ��H <0������������ȷ��
A. ����Ӧ���Ũ�ȣ����������Ӱٷ��������� v����������������С
B. �����¶ȿ��������ӵ���������v��������v���棩������v���������ĸ���
C. ���ô��������������Ӱٷ��������Ի�����v��������v���棩ͬʱ����������ı�����ͬ
D. ��Сѹǿ���Խ��͵�λ����ڻ���ӵ���Ŀ������v��������С��v���棩����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com