
【题目】下列关于可逆反应:A(g)+3B(g) ![]() 2C(g) △H <0,下列叙述正确的
2C(g) △H <0,下列叙述正确的
A. 增大反应物的浓度,可以提高活化分子百分数,所以 v(正)会先增大后减小
B. 升高温度可以提高活化分子的能量所以v(正)、v(逆)都增大,但v(正)增的更大
C. 采用催化剂,可以提高活化分子百分数,所以会引起v(正)、v(逆)同时增大且增大的倍数相同
D. 减小压强可以降低单位体积内活化分子的数目,所以v(正)减小、v(逆)增大
科目:高中化学 来源: 题型:
【题目】下列A~H八种物质存在如下图所示的转化关系(反应条件、部分产物未标出)。已知A是正盐,B能使品红溶液褪色,G是红棕色气体。试回答下列问题:
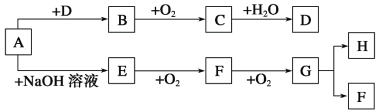
(1)写出下列各物质的化学式:A________________;B________________。
(2)按要求写出下列反应的有关方程式
E→F反应的化学方程式_____________________________________________________;
G→H反应的离子方程式_____________________________________________________。
(3)写出H的浓溶液与木炭反应的化学方程式_______________________________________。
(4)检验D中阴离子的方法是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 100g质量分数为 46%C2H5OH溶液中所含O—H数目约为7NA
B. 质量为12g的12C含有的中子数为12NA
C. 将0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA
D. 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) △H=—148.9kJ/mol。
SiF4(g)+ 2H2O(g) △H=—148.9kJ/mol。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________,其第一电离能比Be___________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________,写出[BH4]-的一种阳离子等电子体_______。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________。

(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________。
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量的计算式是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
A. 向水中加入少量的CH3COOH
B. 向水中加入少量的NaHSO4
C. 加热水至100 ℃,pH=6
D. 向水中加少量的氯化铵固体使由水电离出C(H+)=1.010-5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,有关说法正确的

A. a、b、c三点溶液的c(CH3COO-):a>b>c
B. a、b、c三点醋酸的电离程度: b > a >c
C. a、b、c三点溶液用等体积的氢氧化钾溶液中和,消耗氢氧化钾溶液浓度:a>b>c
D. 若使b 点溶液中的PH值增大,可采取的措施是稀释溶液或加入醋酸钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com