
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
【答案】6c-a-3b Fe ![]() A
A 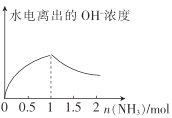 N2+6e-+6H+=2NH3 超过一定电压以后,H+得电子变成H2
N2+6e-+6H+=2NH3 超过一定电压以后,H+得电子变成H2
【解析】
(1)焓变=反应物总键能-生成物总键能;
(2)①反应速率越慢,活化能越大;
②利用“三段式”计算平衡常数Kp;
(3)根据影响反应速率、影响平衡移动的因素分析;
(4)盐酸、氨水抑制水电离,氯化铵促进水电离;
(5)①阴极氮气得电子生成氨气;
②根据图示,阴极有可能生成H2;
(1)焓变=反应物总键能-生成物总键能,N![]() N键、H—H键和N—H键的键能值分别记作a、b和c,2NH3(g)
N键、H—H键和N—H键的键能值分别记作a、b和c,2NH3(g)![]() N2(g)+3H2(g) △H=(6c-a-3b) kJmol-1;
N2(g)+3H2(g) △H=(6c-a-3b) kJmol-1;
(2)①根据表格数据,Fe作催化剂时反应速率最慢,氨气分解反应的活化能最大的是Fe;
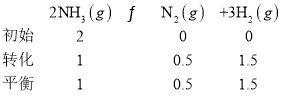
反应后气体的物质的量是反应前的![]() 倍,所以反应后的总压强为
倍,所以反应后的总压强为![]() ;Kp=
;Kp=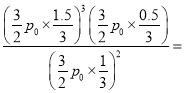
![]() ;
;
(3)A.合成氨工业常采用的反应温度为500℃左右,主要是为了加快反应速率,故A错误;
B.催化剂能加快反应速率,不能使平衡移动,使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率,故B正确;
C.加压,2NH3(g)![]() N2(g)+3H2(g) 平衡逆向移动,合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高,故C正确;
N2(g)+3H2(g) 平衡逆向移动,合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高,故C正确;
故选A;
(4)盐酸抑制水电离,在1L1molL-1盐酸中缓缓通入氨气,盐酸生成氯化铵,盐酸浓度减小,水电离程度增大,通入1mol氨气时,恰好生成氯化铵,水的电离程度达到最大,再通入氨气,生成氨水,抑制水电离;图象为 。
。
(5)①阴极氮气得电子生成氨气,阴极反应式是N2+6e-+6H+=2NH3;
②根据图示,随着电压的增大,阴极H+得电子变成H2,所以氨气的体积分数随着电压的增大而减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取I2的流程如图:
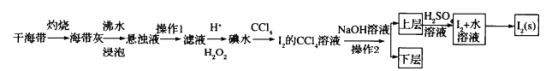
请回答下列问题:
(1)灼烧的目的是______。
(2)操作1的名称为_______
(3)滤液中加入H+、H2O2后发生反应的离子方程式为_________
(4)操作2所使用的玻璃仪器为______
(5)若加入NaOH溶液后生成的氧化产物与还原产物的物质的量之比为1:5,则该反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
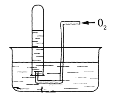
A.可能是N2与NO2的混合气体B.可能是O2与NO2的混合气体
C.可能是NO与N2的混合气体D.只能是NO2一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是( )
A.熬胆矾(CuSO4·5H2O)铁釜,久之亦化为铜B.千淘万漉虽辛苦,吹尽狂沙始到金
C.凡石灰(CaCO3)经火焚炼为用D.丹砂(HgS)烧之成水银,积变又成丹砂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如图:
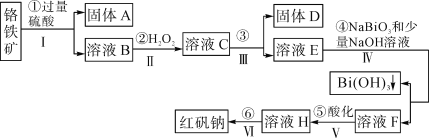
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是___。
(2)步骤③加的试剂为___,目的是将溶液pH要调到5使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
(3)写出反应④的离子反应方程式___。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程___。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是___(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示:
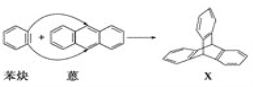
(1)蒽与X都属于___(填字母)。
a.饱和烃 b.不饱和烃
(2)苯炔的分子式为___,苯炔不具有的性质是___(填字母)。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(3)下列属于苯的同系物的是___(填字母,下同)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(4)下列物质中,能发生加成反应,也能发生取代反应,同时能使溴水因加成反应而褪色,还能使酸性高锰酸钾溶液褪色的是___。
A.![]() B.C6H14 C.
B.C6H14 C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据官能团的不同对下列有机物进行分类。把正确答案的序号填写在题中的横线上。
①CH3CH2OH②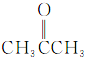 ③
③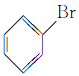 ④
④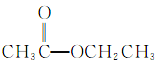 ⑤
⑤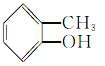 ⑥
⑥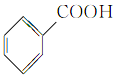 ⑦
⑦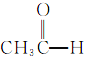 ⑧
⑧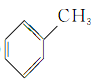
(1)芳香烃:__;(2)卤代烃:__;
(3)醇:__;(4)酚:___;
(5)醛:___;(6)酮:___;
(7)羧酸:__;(8)酯:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com