
【题目】根据官能团的不同对下列有机物进行分类。把正确答案的序号填写在题中的横线上。
①CH3CH2OH②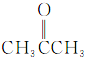 ③
③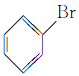 ④
④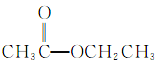 ⑤
⑤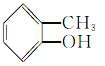 ⑥
⑥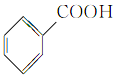 ⑦
⑦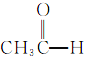 ⑧
⑧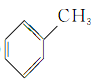
(1)芳香烃:__;(2)卤代烃:__;
(3)醇:__;(4)酚:___;
(5)醛:___;(6)酮:___;
(7)羧酸:__;(8)酯:__。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
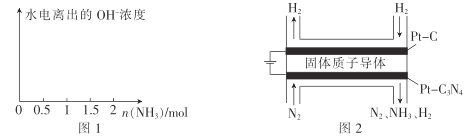
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:
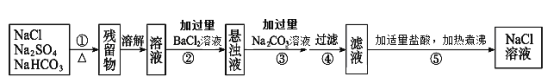
回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:① 2NO(g)+O2(g)![]() 2NO2(g)△H3=﹣112.0kJmol﹣1
2NO2(g)△H3=﹣112.0kJmol﹣1
② NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)△H2=﹣379.9kJmol﹣1
N2(g)+CO2(g)△H2=﹣379.9kJmol﹣1
③ N2(g)+O2(g)![]() 2NO(g)△H1=+179.8kJmol﹣1
2NO(g)△H1=+179.8kJmol﹣1
则反应NO(g)+CO2(g)![]() NO2(g)+CO(g)的△H=_____kJmol﹣1;某温度下,反应①②③的平衡常数分別为K1、K2、K3,则该反应的K= ____(用K1、K2、K3表示)。
NO2(g)+CO(g)的△H=_____kJmol﹣1;某温度下,反应①②③的平衡常数分別为K1、K2、K3,则该反应的K= ____(用K1、K2、K3表示)。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g) ![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
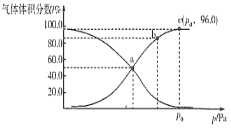
①a、b、c三点逆反应速率由大到小的顺序为___________。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡___________移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=___________Pa-1。
(3) 常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。
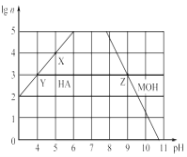
①HA为______酸,MOH为 ________碱(填“强”或“弱”);
②X、Y、Z三点水的电离程度关系是:________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家JohnB.Goodenough荣获2019年诺贝尔化学奖,他指出固态体系锂电池是锂电池未来发展方向。Kumar等人首次研究了固态可充电、安全性能优异的锂空气电池,其结构如图所示。已知单位质量的电极材料放出电能的大小称为电池的比能量。下列说法错误的是( )
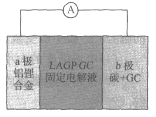
A.a极反应为“Li-e-=Li+,b极发生还原反应
B.充电时,Li+由a极通过固体电解液向b极移动
C.电路中转移4mol电子,大约需要标准状况下112L空气
D.与铅蓄电池相比,该电池的比能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D有如下转化关系。回答下列问题:
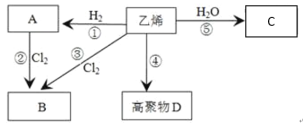
(1)乙烯的电子式为_______,分子中含有的共价键类型有_______(填极性键或非极性键)。
(2)写出下列反应的化学方程式和有机反应类型:
反应④_______,反应类型:________;反应⑤________,反应类型:________。
(3)反应②和反应③都可以用来制备物质B,反应②的条件为_________。
(4)某单烯烃通过加成反应得到的某烷烃的相对分子质量为86,则该烯烃的分子式为____,该烷烃存在多种同分异构体,请写出只能由一种烯烃加成得到的烷烃的结构简式:_______,并用系统命名法命名:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺 G 是一种可用于治疗肿瘤的药物。实验室由芳香烃 A 制备 G 的合成路线如下:
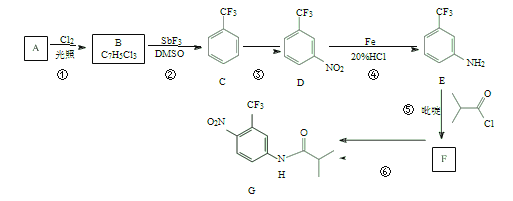
回答下列问题:
(1)C 的名称是_____________。
(2)③的反应试剂和反应条件分别是_____________,该反应类型是_____________。
(3)⑤的反应方程式为______________。
(4)G 的分子式为_____________。
(5)H 是G 的同分异构体,其苯环上的取代基与G 的相同但位置不同,则H 可能的结构有_____________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备 4-甲氧基乙酰苯胺的合成路线______________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,其他试剂任选)
)制备 4-甲氧基乙酰苯胺的合成路线______________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。
2C(g)。
相关数据如下表,反应过程中C的浓度随时间变化关系如下图。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0. 5 mol B | 6 mol A 2 mol B |
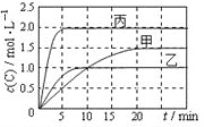
A. T1>T2,x=1
B. T2℃时,该反应的平衡常数为0. 8
C. A的平衡转化率a(甲):a(乙)=2:3
D. 15~20min内C的平均反应速率v(乙)< v(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com