
| 0.9 |
| Mr |
| 1.12 |
| 22.4 |
| 0.9 |
| Mr |
| 1.12 |
| 22.4 |
 ,D为硫元素,在元素周期表中第三周期VIA族,
,D为硫元素,在元素周期表中第三周期VIA族, ;第三周期VIA族;
;第三周期VIA族;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、标准状况下,22.4L氦气含有原子个数为NA |
| D、标准状况下,22.4 LH2O中含原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
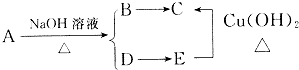
查看答案和解析>>
科目:高中化学 来源: 题型:
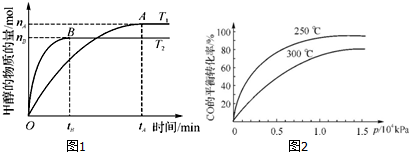
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
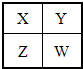 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径大 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、Y的气态氢化物的稳定性一定比W的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
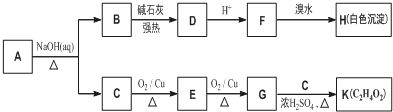
| CaO |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com