
| 1 |
| 2 |
| 1 |
| 2 |
| 3 | 4.0×10-12 |
| 1.8×10-10 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温常压下,11.2LCO2所含原子数为1.5NA |
| B、常温常压下,48克O3含有的氧原子数为3NA |
| C、标准状况下,22.4L H2中所含原子数位NA |
| D、标准状况下,1LH2O所含分子数为NA/22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原来盐酸的物质的量浓度等于氨水的物质的量浓度 |
| B、所得溶液中c(NH4+)=c(Cl-) |
| C、所得溶液中c(NH4+)+c(H+)=c(Cl-) |
| D、所得溶液中c(NH4+)+c(NH3?H2O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X分子中肯定有碳碳双键 |
| B、X分子中可能有三个羟基和一个-COOR官能团 |
| C、X分子中可能有三个羧基 |
| D、X分子中可能有一个羟基和二个羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
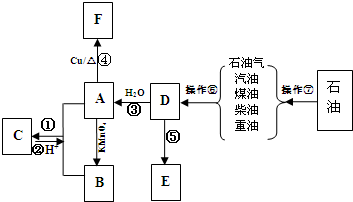
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和⑥ | B、①②③④和⑥ |
| C、①②③和⑥ | D、①②③和④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com