
| A、原来盐酸的物质的量浓度等于氨水的物质的量浓度 |
| B、所得溶液中c(NH4+)=c(Cl-) |
| C、所得溶液中c(NH4+)+c(H+)=c(Cl-) |
| D、所得溶液中c(NH4+)+c(NH3?H2O)=c(Cl-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、增大压强,有利于SO2与O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
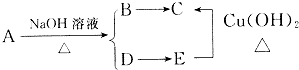
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素是非金属元素 |
| B、该元素最外层有三个电子 |
| C、该元素所形成的最高价氧化物的水化物是一种强酸 |
| D、该元素的第一电离能比同周期右边相邻的元素的第一电离能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
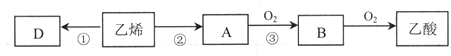
查看答案和解析>>
科目:高中化学 来源: 题型:
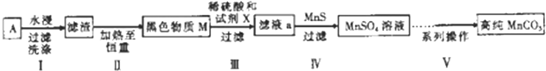
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
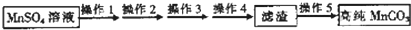
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com