
【题目】下列物质属于能够导电的电解质是( )
A. Cu B. 盐酸 C. NaCl晶体 D. 熔融KNO3
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
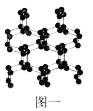
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
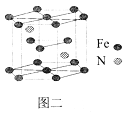
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是人体常用的补铁剂,缺少Fe2+会导致缺铁性贫血。绿矾(FeSO4·7H2O)在不同温度下易分解得各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红等。回答下列问题:

(1)第一组同学按照上图装置做绿矾的分解实验,并检验其分解产物。装置B中观察到品红褪色,第一组同学得出结论:绿矾的分解产物中含有______________________。
(2)第二组同学为了进一步探究褪色的原因,对第一组同学做完实验B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中________。(填字母)
A.不含SO2 B.一定含有SO3 C.可能含SO2
(3)第三组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,第三组同学从下图中选取了部分仪器设计了一套检验绿矾分解的气体产物装置:

①第三组同学的实验装置中,依次连接的合理顺序为a→___→ → → → 。
②验证分解产物中有O2的简要实验操作步骤及现象是____________________________
(4)检验绿矾分解产物中含有三价铁,应选用的实验仪器有试管、胶头滴管、_______;选用的试剂为____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)分子中有6个甲基,而一溴代物只有1种的烷烃,结构简式是________。
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
![]()
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,与水加成时,生成的主要产物为C,
且B中仅含有4个碳原子、1个溴原子、1种氢原子,则B的结构简式为:_________。
A与水在催化剂存在下发生加成反应的化学方程式___________________。(只写主要产物)。
Ⅱ、卤代烃在碱性醇溶液中能发生消去反应。下面是六个有机化合物的转换关系。请回答下列问题:
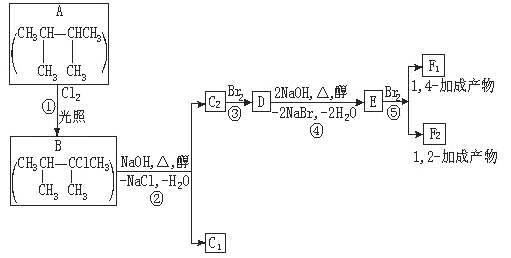
(1)上述框图中,①是___________反应。
(2)化合物E是重要的工业原料,写出由D生成E的化学方程式____________。
(3)C1的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A、B、C、D的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物,丙分子中原子个数比为1:1,乙是元素D的单质,通常为深红棕色液体,丁为淡黄色固体,0.01 mol/L戊溶液的pH为2,己为难溶于水、密度比水大的油状物。上述物质的转化关系如图所示。下列说法中不正确的是
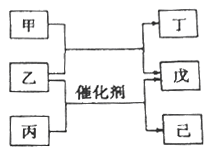
A. 四种元素既不同周期也不同主族
B. 元素的非金属性A<B<C
C. 丙常温常压下为气态
D. C的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+=Cr2O72-+H2O)。下列说法正确的是
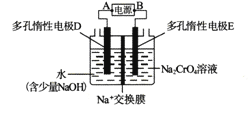
A. A为正极,B为负极
B. 电解过程中,电解槽左侧溶液pH增大
C. 电解过程中,Na+在电解槽中自左向右迁移
D. 当电路中通过lmol电子时,阴极生成0.5mol Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________。
(2) RO3-的立体构型是______________,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____(填元素符号), 原因是_____。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
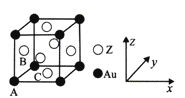
① 该晶体中,Z与Au的原子个数比为_________;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______nm。(列出表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Al(OH)3可用于制胃酸中和剂
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.在AlCl3溶液中加入过量的NaOH溶液可制得Al(OH)3沉淀
D.NaHCO3、Na2CO3、Fe(OH)3三种固体受热后均能生成气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com