
| A、水银、硫酸、烧碱、硫酸氢钠 |
| B、碘酒、盐酸、烧碱、硫酸钡 |
| C、氧气、硝酸、纯碱、胆矾 |
| D、铁、醋酸、碱式碳酸铜、氯化铜 |


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol稀H2SO4与足量NaOH溶液反应 |
| B、稀盐酸与氨水反应生成1 mol H2O |
| C、稀NaOH与95%浓硫酸反应生成1 mol水 |
| D、稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14g乙烯和丁烯的混合物中含有的原子总数为3NA个 |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
C、1mol苯乙烯( 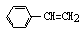 )中含有的C=C数为4NA )中含有的C=C数为4NA |
| D、7g CnH2n中含有的氢原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医用酒精 | B、HCl(气态) |
| C、水煤气 | D、豆浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、道尔顿提出原子学说 |
| B、汤姆生发现电子,并提出原子结构轨道模型 |
| C、舍勒发现了氯气 |
| D、卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、NO3-、K+ |
| B、Fe2+、H+、NO3-、SO42- |
| C、Al3+、Mg2+、NO3-、OH- |
| D、Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com