
| m |
| M |
| n |
| V |
| 2.33g |
| 233g/mol |
| 0.01mol |
| 0.1L |
| 3.42g |
| 171g/mol |
| 0.01mol |
| 0.1L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有元素中钠的第一电离能最小 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、在所有元素中,氟的第一电离能和电负性值都是最大 |
| D、氮、氧、氟的原子半径小,电负性值大,与氢形成的共价键极性强,容易形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D、NCl3分子中所有的原子均为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、过氧化钠的电子式: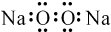 | ||
B、质子数为35、中子数为45的溴原子:
| ||
| C、氯化铵、次氯酸都属于强电解质 | ||
| D、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水银、硫酸、烧碱、硫酸氢钠 |
| B、碘酒、盐酸、烧碱、硫酸钡 |
| C、氧气、硝酸、纯碱、胆矾 |
| D、铁、醋酸、碱式碳酸铜、氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①② | B、只有②③ |
| C、①②③ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 其一种原子的原子核内无中子 |
| B | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| C | C原子的M层电子数是K层的3倍 |
| D | D2+的水溶液呈蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com