
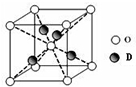
 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 其一种原子的原子核内无中子 |
| B | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| C | C原子的M层电子数是K层的3倍 |
| D | D2+的水溶液呈蓝色 |
| ||
| ||
| 1 |
| 8 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、NO3-、K+ |
| B、Fe2+、H+、NO3-、SO42- |
| C、Al3+、Mg2+、NO3-、OH- |
| D、Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
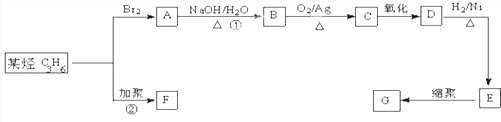
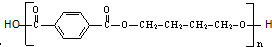 )是一种重要的工程塑料.
)是一种重要的工程塑料.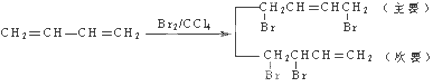
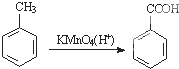
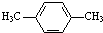 为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH
为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
 合成PBT的反应流程图为:
合成PBT的反应流程图为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |
查看答案和解析>>
科目:高中化学 来源: 题型:
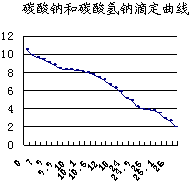 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 说明产品中含有NaHCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物都是强电解质 |
| B、一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
| C、在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 |
| D、能与金属镁反应产生氢气的溶液一定是酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com