
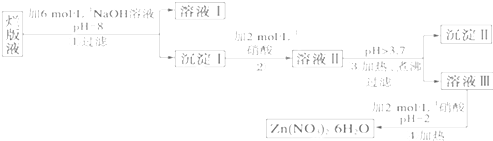


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、只有①② | B、只有②③ |
| C、①②③ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| A | 其一种原子的原子核内无中子 |
| B | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| C | C原子的M层电子数是K层的3倍 |
| D | D2+的水溶液呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
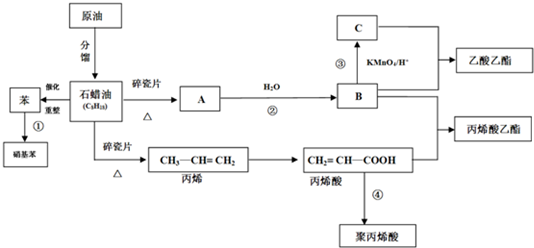
查看答案和解析>>
科目:高中化学 来源: 题型:
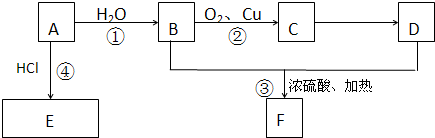
查看答案和解析>>
科目:高中化学 来源: 题型:
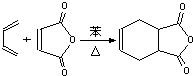 双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖.如图:
双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖.如图:| ①KMnO4/OH-②H+ |
| CrO3,吡啶 |
| CH2Cl2 |
| 500℃ |
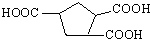 可由烃A和酯B按下列路线合成:
可由烃A和酯B按下列路线合成:
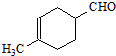 过程.
过程.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Mg2+、NO3-、Cl- |
| B、K+、Na+、HCO3-、Cl- |
| C、K+、Na+、SO42-、Cl- |
| D、NH4+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com