
26.(14分)铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式 ;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式________________________。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3 □CuSO4 +□ Cu(NO3)2+□NO↑+ □
□CuSO4 +□ Cu(NO3)2+□NO↑+ □
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为 (填化学式)。
(1)2Fe3+ + Cu == 2Fe2+ + Cu2+
(2)2Cu+O2+2H2SO4 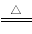 2CuSO4+2H2O
2CuSO4+2H2O
(3)Al2O3 + 3Cl2 + 3C  2AlCl3 + 3CO↑
2AlCl3 + 3CO↑
(4)3,16, 3, 3,10 , 8H2O
(5)Fe8Al4Si
【解析】
试题分析:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应方程式为2Fe3+ + Cu == 2Fe2+ + Cu2+;(2)因溶液中有O2,加热能使铜生成氧化铜,氧化铜再与硫酸反应生成硫酸铜,总反应为2Cu+O2+2H2SO4  2CuSO4+2H2O;(3)根据题意可得,反应物为氧化铝、C和Cl2,反应条件是加热,生成物是氯化铝和CO,因而反应方程式为Al2O3 + 3Cl2 + 3C
2CuSO4+2H2O;(3)根据题意可得,反应物为氧化铝、C和Cl2,反应条件是加热,生成物是氯化铝和CO,因而反应方程式为Al2O3 + 3Cl2 + 3C  2AlCl3 + 3CO↑;(4)根据化合价的升降守恒对方程式进行配平,根据原子守恒可知生成物为H2O,得方程式为3Cu2S +16HNO3
2AlCl3 + 3CO↑;(4)根据化合价的升降守恒对方程式进行配平,根据原子守恒可知生成物为H2O,得方程式为3Cu2S +16HNO3  3CuSO4 +3 Cu(NO3)2+10NO↑+ 8H20;(5)准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g,由于铝和铁均可溶于盐酸,因而0.07g固体为Si,向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,足量的氢氧化钠使铝完全溶解,因而得到的红棕色粉末即为Fe2O3,计算可得n(Si)=
3CuSO4 +3 Cu(NO3)2+10NO↑+ 8H20;(5)准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g,由于铝和铁均可溶于盐酸,因而0.07g固体为Si,向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,足量的氢氧化钠使铝完全溶解,因而得到的红棕色粉末即为Fe2O3,计算可得n(Si)= =0.0025mol, n(Fe)=
=0.0025mol, n(Fe)= =0.02mol,m(Fe)=1.12g,那么m(Al)=0.27g,n(Al)=0.01mol,得n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,故合金的组成为Fe8 Al4 Si。
=0.02mol,m(Fe)=1.12g,那么m(Al)=0.27g,n(Al)=0.01mol,得n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,故合金的组成为Fe8 Al4 Si。
考点:金属及其化合物的性质及相关计算


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:填空题
化学与生产、生活密切相关。从化学视角回答下列问题:
(1)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于____效应,工业上制造光导纤维的基本原料是 。
(2)pH< 的雨水称为酸雨,我国形成酸雨的主要污染物是 。
(3)化工厂曾用浓氨水来检验氯气管道是否漏气,反应原理为(在有水蒸气存在时):2NH3+3Cl2==6HCl+N2。如果氯气管道某处漏气,用该方法检查时的现象是___________。
(4)碳酸氢铵俗称碳铵,是一种廉价氮肥,它的最大缺点是 。如果向碳酸氢铵溶液中滴加NaOH溶液至过量,反应的离子方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
下列溶液中,Na+ 物质的量浓度最大的是
A.10 mL 0.4 mo l·L-1 NaOH溶液 B.5 mL 0.3 mo l·L-1 Na3PO4溶液
C.10 mL 0.3 mo l·L-1 Na2SO4溶液 D.5 mL 0.5 mol·L-1 NaNO3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第五次月考理综化学试卷(解析版) 题型:选择题
9、下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象 | 结论 | |
A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色。 | 该溶液一定是钠盐溶液 |
C | 向饱和Na2CO3溶液中通入足量CO2 ,溶液变浑浊 | 析出了NaHCO3 |
D | 常温下,将Al箔插入浓HNO3中,无明显现象。 | 铝和浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:填空题
18.(共6分)现有下列浓度均为0.1 mol/L的电解质溶液:
① Na2CO3、② NaHCO3、③ 、④ CH3COONH4、⑤ NH4HCO3
、④ CH3COONH4、⑤ NH4HCO3
(1)上述5种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序号) 。
(2)已知溶液④呈中性,该溶液中离子浓度由大到小的顺序是 。
(3)已知溶液⑤呈碱性,比较④、⑤两溶液的酸碱性,可以得出的结论是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
1.下列叙述中不正确的是
A.SO2是大气污染物之一
B.食物腐败变质发生了化学变化
C.凡含有添加剂的食物对人体健康均有害,不宜食用
D.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
8. 在2NO2(红棕色)  N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
N2O4(无色)的可逆反应中,下列状态一定达到化学平衡状态的是
A.N2O4和NO2的分子数比为1︰2
B.N2O4和NO2的浓度相等
C.单位时间内1 mol N2O4消耗的同时有2 mol NO2生成
D.平衡体系的颜色不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com