
【题目】测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
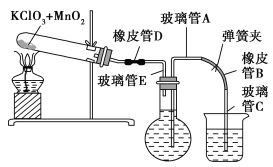
①按下图装配实验装置。
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列物质所占体积最大的是(NA表示阿伏加德罗常数)( )
A.18gH2OB.NA个氮气分子C.44.8L HCLD.含有5NA个氢原子的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于皂化反应的说法中错误的是 ( )
A.油脂经皂化反应后,生成的是高级脂肪酸钠、甘油和水形成混合液
B.加入食盐可以使肥皂析出,这一过程叫盐析
C.加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠
D.皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为正盐。根据下列变化进行推断,回答有关问题:

(1)推断A、B、C、D的化学式:A________、B________、C________、D________。
(2)写出下列反应的离子方程式:
反应①生成气体B:__________________________________________________;
反应②白色沉淀溶解:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g) B(g)+C(g)
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是______________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A.钠和氯化铝溶液B.铝和烧碱溶液C.过氧化钠和氯化亚铁D.锌和稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是
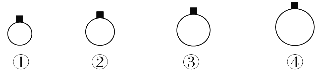
A. 气球②中装的是O2
B. 气球①和气球③中气体分子数相等
C. 气球③和气球④中气体密度之比为2∶1
D. 气球①和气球④中气体物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Cu、Cu2O和CuO固体混合物,将其分成两等份,一份用足量的氢气还原,反应后固体质量减少6.40g,另一份加入1000mL稀硝酸,固体恰好完全溶解,收集到标准状况下NO气体4.48L,所用硝酸的物质的量浓度为
A. 3.2mol/L B. 1.6mol/L C. 0.9mol/L D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com