
【题目】在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g) B(g)+C(g)
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是______________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
【答案】 升高温度、降低压强 (![]() -1)×100% 94.1% 1.5 mol·L-1 0.10×
-1)×100% 94.1% 1.5 mol·L-1 0.10×![]() 0.10×(2-
0.10×(2-![]() ) 0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
) 0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
【解析】试题分析:(1) 由于反应A(g)![]() B(g)+C(g) ΔH =+85.1kJ·mol-1的正反应是气体体积增大的吸热反应,所以欲提高A的平衡转化率,是平衡正向移动,根据平衡移动原理,应采取的措施为升高温度或降低压强。(2)根据反应方程式中物质的量的关系可知,压强比等于物质的量的比。由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为α(A)=
B(g)+C(g) ΔH =+85.1kJ·mol-1的正反应是气体体积增大的吸热反应,所以欲提高A的平衡转化率,是平衡正向移动,根据平衡移动原理,应采取的措施为升高温度或降低压强。(2)根据反应方程式中物质的量的关系可知,压强比等于物质的量的比。由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为α(A)=![]() =
=![]() ;平衡时A的转化率为α(A)=(9.53-4.91)÷4.91×100%=94.1%;反应达到平衡时各物质的物质的量浓度为(1-94.1%)×0.10 mol/L、94.1%×0.10 mol/L、94.1%×0.10 mol/L。所以平衡常数K=(94.1%×0.10 )2÷(1-94.1%)×0.10=1.5;(3) ①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),由于对气体来说,在相同的条件下,体积比等于物质的量的比,等于压强的比,所以n总=0.1×
;平衡时A的转化率为α(A)=(9.53-4.91)÷4.91×100%=94.1%;反应达到平衡时各物质的物质的量浓度为(1-94.1%)×0.10 mol/L、94.1%×0.10 mol/L、94.1%×0.10 mol/L。所以平衡常数K=(94.1%×0.10 )2÷(1-94.1%)×0.10=1.5;(3) ①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),由于对气体来说,在相同的条件下,体积比等于物质的量的比,等于压强的比,所以n总=0.1×![]() ;n(A)= 0.1×(2-
;n(A)= 0.1×(2-![]() );②(4-0):(0.10-a)=(8-4):(a-0.026),解得a=0.051.根据表格中物质的浓度与时间的关系可看出:每间隔4小时,A的浓度为原来的一半。由此规律推出反应在12h时反应物的浓度.假设c(A)为="x," x="0.026mol/L÷2=" 0.013mol/L.
);②(4-0):(0.10-a)=(8-4):(a-0.026),解得a=0.051.根据表格中物质的浓度与时间的关系可看出:每间隔4小时,A的浓度为原来的一半。由此规律推出反应在12h时反应物的浓度.假设c(A)为="x," x="0.026mol/L÷2=" 0.013mol/L.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 _______、________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____(填“能”或“否”),其原因是 ______________________。
(3)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。
①计算完成上表数据计算结果。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:___________________________________ 。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,会使测定结果△H_____(填“偏大”、 “偏小” 或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为
ρ g·cm-3,质量分数为w,其中含NH![]() 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为w=![]() ×100%
×100%
C. 溶液中c(OH-)=![]() mol·L-1
mol·L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾在高温下易分解,用右图装置检验绿矾的分解产物(加热装置已略去)。化学方程式为:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
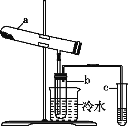
A. SO2是还原产物,Fe2O3是氧化产物
B. b中所得到的硫酸的质量分数理论上为29.5%
C. 将反应后的气体通入氯化钡溶液中,产生的沉淀为BaSO3、BaSO4
D. 将反应后的气体通入硝酸钡溶液中,产生的沉淀为只有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。
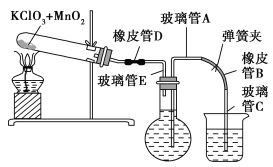
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是 。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致? 。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为 L;混合物中MnO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为元素周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关问题均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_____________________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是_______________。
(3)X与Z中电负性较大的是_________;Z的某种含氧酸盐常用于实验室中X单质的制取,此酸根离子的空间构型是__________,此离子中含有的化学键类型是__________;X—Z—X的键角______109°28'(填“>”“<”或“=”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以距离一个X离子最近的所有Y离子为顶点构成的几何体为________。该化合物与MgO相比,熔点较高的是____________。
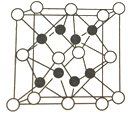
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为_________g/cm3。(列算式,不必计算出数值,阿伏伽德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原子可能处于同一平面
C. x的同分异构体只有y和z两种
D. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
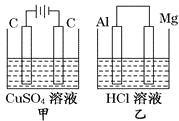
A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com