
【题目】电能是现代社会应用最广泛的能源之一。
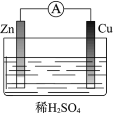
(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
【答案】负 Zn-2e=Zn2+ 还原 Zn Zn ②③
【解析】
在铜锌原电池中,发生的化学反应是氧化还原反应,锌是还原剂,失去电子被氧化,锌作负极,电子从锌片流出,经导线流向铜,铜作正极,H+在正极上氧化剂得到电子,发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此回答;
(1)Zn电极为原电池的负极,电极反应式是Zn-2e=Zn2+;Cu电极上发生的反应属于还原反应,电子由Zn极流出,电解质溶液中SO![]() 移向Zn极;
移向Zn极;
答案为:负;Zn-2e=Zn2+;还原;Zn;Zn;
(2)①CaO+H2O=Ca(OH)2是非氧化还原反应,不能设计成原电池,①错误;②2H2+O2 =2H2O可自发发生的氧化还原反应,是放热反应,②正确;③2FeCl3+Cu=CuCl2+2FeCl2是可自发发生的氧化还原反应,是放热反应,③正确;
答案为:②③。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有关说法正确的是( )
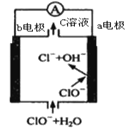
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,c溶液中的溶质是MgCl2
C.负极反应式:ClO-+2e-+H2O=Cl-+2OH-
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2molCl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极)。下列说法正确的是( )
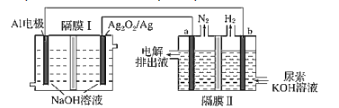
A.Ag电极是正极,反应后该电极区溶液pH减小
B.原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O
C.每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
D.a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:
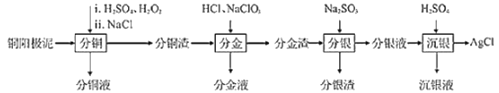
已知:ⅰ.分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ.分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-Ag++2SO32-
ⅲ.“分铜”时各元素的浸出率如表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。
(2)“分金”时,单质金发生反应的离子方程式为______。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
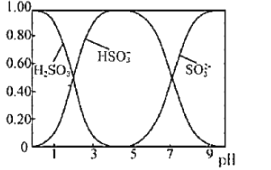
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
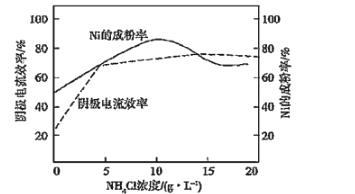
为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为______,表示其中和热的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的硫酸亚铁和硫酸铁的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在![]() 的磁流体。下列说法中正确的是( )
的磁流体。下列说法中正确的是( )
A.该磁流体是一种纯净物B.所得的磁流体为悬浊液
C.该磁流体很不稳定D.所得的磁流体能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类正确的一组是( )
①液氨、液氧、干冰、纯碱均为化合物 ②盐酸、氢氧化铁胶体、空气、氨水均为混合物 ③氢氧化钾、小苏打、硫酸、烧碱均为电解质 ④碘酒、牛奶、豆浆、肥皂水均为胶体 ⑤![]() 、
、![]() 、
、![]() 、
、![]() 均为钠盐
均为钠盐
A.①和②B.②和③C.②和④D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在古代,橘红色的铅丹(Pb3O4)用于入药和炼丹,人们对其中重金属铅的毒性认识不足。已知:PbO2为棕黑色粉末。某化学兴趣小组对铅丹的一些性质进行实验探究并测定其组成。
回答下列问题:
(1)性质实验
实验操作 | 现象 | 解释或结论 |
①将适量铅丹样品放入小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌 | _____ | Pb3O4+4HNO3=PbO2+ 2Pb(NO3)2+2H2O |
②将上述混合物过滤,所得滤渣分为两份,一份加入2mL浓盐酸,加热 | 有刺激性的黄绿色气体产生 | 反应的化学方程式: _______ |
③另一份滤渣加入硝酸酸化的Mn(NO3)2溶液,搅拌 | 得紫色溶液 | 结论:_______ |
(2)组成测定
①准确称取0.530g干燥的铅丹样品,置于洁净的小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌使之充分反应,分离出固体和溶液。该分离操作名称是_____________。
②将①中所得溶液全部转入锥形瓶中,加入指示剂和缓冲溶液,用0.04000mol/L的EDTA溶液(显酸性)滴定至终点,消耗EDTA溶液36.50mL。EDTA与Pb2+的反应可表示为Pb2++H2Y2-=PbY2-+2H+,滴定时EDTA溶液应盛装在_______________中。滤液中含Pb2+__________mol。
③将①中所得固体PbO2全部转入另一锥形瓶中,往其中加入适量HAc与NaAc的混合液和8g固体 KI,摇动锥形瓶,使PbO2全部反应而溶解,发生反应PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,此时溶液呈透明棕色。以0.05000mol/L的Na2S2O3标准溶液滴定,发生反应I2+2S2O32-=S4O62-+2I-,至溶液呈淡黄色时加入2%淀粉溶液1mL,继续滴定至溶液_______,即为终点,用去Na2S2O3溶液30.80mL。
根据②、③实验数据计算,铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)请写出A装置中发生反应的化学方程式_____。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。
A.N![]() S溶液 B.N
S溶液 B.N![]() S
S![]() 溶液 C.N
溶液 C.N![]() S
S![]() 溶液
溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比![]() S稳定 ②HClO氧化性比
S稳定 ②HClO氧化性比![]() S
S![]() 强 ③HCl
强 ③HCl![]() 酸性比
酸性比![]() S
S![]() 强 ④HCl酸性比
强 ④HCl酸性比![]() S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C
S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C![]() 反应生成FeC
反应生成FeC![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
(5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC![]() ,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com