
【题目】在古代,橘红色的铅丹(Pb3O4)用于入药和炼丹,人们对其中重金属铅的毒性认识不足。已知:PbO2为棕黑色粉末。某化学兴趣小组对铅丹的一些性质进行实验探究并测定其组成。
回答下列问题:
(1)性质实验
实验操作 | 现象 | 解释或结论 |
①将适量铅丹样品放入小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌 | _____ | Pb3O4+4HNO3=PbO2+ 2Pb(NO3)2+2H2O |
②将上述混合物过滤,所得滤渣分为两份,一份加入2mL浓盐酸,加热 | 有刺激性的黄绿色气体产生 | 反应的化学方程式: _______ |
③另一份滤渣加入硝酸酸化的Mn(NO3)2溶液,搅拌 | 得紫色溶液 | 结论:_______ |
(2)组成测定
①准确称取0.530g干燥的铅丹样品,置于洁净的小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌使之充分反应,分离出固体和溶液。该分离操作名称是_____________。
②将①中所得溶液全部转入锥形瓶中,加入指示剂和缓冲溶液,用0.04000mol/L的EDTA溶液(显酸性)滴定至终点,消耗EDTA溶液36.50mL。EDTA与Pb2+的反应可表示为Pb2++H2Y2-=PbY2-+2H+,滴定时EDTA溶液应盛装在_______________中。滤液中含Pb2+__________mol。
③将①中所得固体PbO2全部转入另一锥形瓶中,往其中加入适量HAc与NaAc的混合液和8g固体 KI,摇动锥形瓶,使PbO2全部反应而溶解,发生反应PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,此时溶液呈透明棕色。以0.05000mol/L的Na2S2O3标准溶液滴定,发生反应I2+2S2O32-=S4O62-+2I-,至溶液呈淡黄色时加入2%淀粉溶液1mL,继续滴定至溶液_______,即为终点,用去Na2S2O3溶液30.80mL。
根据②、③实验数据计算,铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为____________。
【答案】固体由橘红色变为棕黑色 PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O 在酸性溶液中,PbO2能够将Mn2+氧化为MnO4- 过滤、洗涤、干燥 酸式滴定管 1.460×10-3 蓝色褪去且半分钟内不恢复 1.90
PbCl2+Cl2↑+2H2O 在酸性溶液中,PbO2能够将Mn2+氧化为MnO4- 过滤、洗涤、干燥 酸式滴定管 1.460×10-3 蓝色褪去且半分钟内不恢复 1.90
【解析】
(1)①由化学方程式及物质的物理性质总结反应现象,②黄绿色气体为氯气,HCl氧化为氯气,则PbO2发生还原,③紫色是MnO4-离子的颜色,在酸性条件下PbO2能够将Mn2+氧化为MnO4-,PbO2发生还原反应变为+2价离子;
(2)①溶液中有固体沉淀的分离步骤是:过滤、洗涤、干燥,②碱性溶液用碱式滴定管盛装,酸性和氧化性溶液用酸式滴定管盛装,根据反应的离子方程式找出关系式进行计算滤液中含Pb2+的物质的量;
(3)碘遇淀粉变蓝色,根据反应的离子方程式找出关系式进行相关计算。
根据以上分析进行解答。
(1)①铅丹样品与HNO3溶液发生反应:Pb3O4+4HNO3=PbO2+2Pb(NO3)2+2H2O,由题中所给Pb3O4 、PbO2物理性质可知反应现象为:固体由橘红色变为棕黑色。
答案为:固体由橘红色变为棕黑色。
② PbO2与浓盐酸加热生成的黄绿色气体为氯气,HCl氧化为氯气,PbO2发生还原变成Pb2+,根据原子守恒写出反应方程式为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。
答案为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。
③ PbO2与硝酸酸化的Mn(NO3)2溶液反应得到的是MnO4-紫色溶液,说明在酸性条件下PbO2能够将Mn2+氧化为MnO4-,PbO2发生还原反应变为Pb2+离子,反应方程式为:5PbO2+ 2Mn2++4H+= 2MnO4-+ 5Pb2++2 H2O。
答案为:在酸性溶液中,PbO2能够将Mn2+氧化为MnO4-。
(2)①溶液中有不溶物分离的操作步骤是:过滤、洗涤、干燥。
答案是:过滤、洗涤、干燥。
②滴定实验中酸性和氧化性溶液用酸式滴定管盛装,所以显酸性的EDTA溶液应盛装在酸式滴定管里,根据反应Pb2++H2Y2-=PbY2-+2H+可得:n(Pb2+)=n(H2Y2-)=36.5010-3L0.0400mol/L=1.46010-3mol。
答案为:酸式滴定管;1.460×10-3 。
(3)该滴定实验使用淀粉溶液作指示剂,而碘遇淀粉变蓝色,当反应I2+2S2O32-=S4O62-+2I-结束时,碘恰好反应完蓝色褪去,所以达到滴定终点的标志是:蓝色褪去且半分钟内不恢复;根据反应:PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,I2+2S2O32-=S4O62-+2I-可得:n(PbO2)=n(I2)=![]() n(S2O32-)=
n(S2O32-)=![]() 0.05000mol/L30.8010-3L=7.710-4mol,所以铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为:1.460×10-3:7.710-4=1.90。
0.05000mol/L30.8010-3L=7.710-4mol,所以铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为:1.460×10-3:7.710-4=1.90。
答案为:蓝色褪去且半分钟内不恢复;1.90。


科目:高中化学 来源: 题型:
【题目】利用所学化学知识,分析并回答下列各小题。
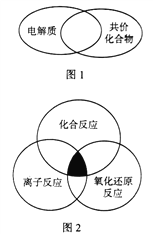
(1)下列物质属于图1所示化学概念交叉部分的有______(填标号)。
a.氨气 b.硝酸 c.乙醇 d.醋酸钠
(2)下列各反应属于图2中阴影部分所示关系的有_______(填标号)。
a.氨气与浓硝酸
b.氢气与氧气
c.氯气与氯化亚铁溶液
d.铜与氯化铁溶液
(3)下列有关说法正确的是_____(填标号)。
a.核电站把核能转化为电能
b.常温下铜与浓硫酸发生钝化。反应很快停止
c.海水中提取化学物质均涉及到氧化还原反应
d.电解法得到某元素单质,则该元素可能被还原,也可能被氧化
(4)下列各实验过程中,需要检查所用某些仪器是否漏水的有_______(填标号)。
a.氢气还原氧化铜
b.水与煤油混合物分离
c.氯化钠溶液与泥沙分离
d.配制100mL 10mol·L-1碳酸钠溶液
(5)下列关于试剂保存的叙述正确的是_________(填标号)。
a.氢氟酸保存在玻璃瓶中
b.KOH溶液保存在带玻璃塞的细口瓶中
c.溴水保存在带橡胶塞的棕色瓶中
d.KMnO4与乙醇不能放在同一药品厨中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。
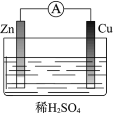
(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重金属离子,有一环境监测小组欲利用
是一种重金属离子,有一环境监测小组欲利用![]() 、
、![]() 、
、![]() 、NaOH等试剂测定某工厂废水中
、NaOH等试剂测定某工厂废水中![]() 的浓度。
的浓度。
(1)现需配制![]() 标准NaOH溶液,所需要的玻璃仪器除量筒、
标准NaOH溶液,所需要的玻璃仪器除量筒、![]() 容量瓶、玻璃棒外,还需要______、_____。
容量瓶、玻璃棒外,还需要______、_____。
(2)需准确称取NaOH固体的质量为______![]() 。
。
(3)在配置以上溶液时,下列操作会使所配溶液浓度偏低的是____(多选题)。
![]() .容量瓶洗涤干净后未干燥
.容量瓶洗涤干净后未干燥 ![]() .定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
![]() .定容时俯视刻度线
.定容时俯视刻度线 ![]() .烧杯和玻璃棒未洗涤
.烧杯和玻璃棒未洗涤
(4)从对化合物分类方法出发,指出下列各组物质中与其他物质类型不同的一种物质.
![]() .
.![]() 、
、![]() 、
、![]() 、
、![]() ________;
________;
![]() .
.![]() 、
、![]() 、
、![]() 、
、![]() ________;
________;
![]() .
.![]() 、
、![]() 、
、、
![]() ________;
________;
![]() .
.![]() 、
、![]() 、
、![]() 、
、![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL 0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是
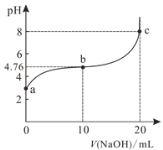
A.a点溶液的pH为2.88
B.b点溶液中:c(Na+)>c(A-)>c(HA)
C.b、c之间一定存在c(Na+)=c(A-)的点
D.a、b、c三点中,c点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
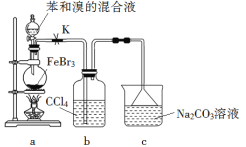
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体反应物既被氧化又被还原的是
A.金属钠露置在空气中迅速变暗
B.露置在空气中的过氧化钠固体变白
C.将氨气与氯化氢混合,产生大量白烟
D.充满二氧化氮的试管倒扣在水槽中,试管内液面上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:
(1)写出相应元素名称: C_________
(2)化合物甲、乙均是由A、C、D、E四种元素组成的中学常见的化合物,甲既能与盐酸反应,又能与NaOH溶液反应,甲溶液和乙溶液反应的离子方程式为:_____________________;丙由C、D、E三种元素组成(原子个数比为3:2:2),乙溶液和丙溶液反应的离子方程式为:_________________。
(3)N2H4的电子式为________。将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________。
Ⅱ 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系。
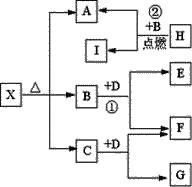
试回答下列问题
(1)G中含有的化学键类型有:_________________。
(2)写出②反应的化学方程式__________________并用双线桥法表示该反应电子转移的方向和数目_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com