
【题目】铝电池性能优越,Al-Ag2O2电池用于电解尿素[CO(NH2)2]的碱性溶液制备氢气(隔膜Ⅱ仅阻止气体通过,a、b均为惰性电极)。下列说法正确的是( )
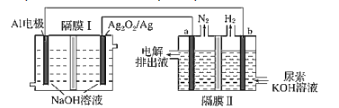
A.Ag电极是正极,反应后该电极区溶液pH减小
B.原电池的总反应为:2Al+3Ag2O2+2NaOH═2NaAlO2+3Ag2O+H2O
C.每消耗2.7g铝,理论上a、b两极共产生气体3.36L(标准状况)
D.a电极上的电极反应为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
【答案】D
【解析】
A、Al-Ag2O2电池工作时,Al失去电子、被氧化、为负极,Ag2O2/Ag电极为正极,Ag2O2发生还原反应生成Ag,反应后该电极区pH增大,而不是减小,故A错误;
B、Al-Ag2O2电池工作时,Al失去电子、被氧化、为负极,Ag2O2/Ag电极为正极,Ag2O2发生还原反应生成Ag,则原电池的总反应方程式错误,故B错误;
C、2.7g的铝物质的量为:0.1mol,所以整个电路转移电子的物质的量为0.3mol,又a电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,b电极反应式为:2H++2e-═H2↑,所以生成氮气的物质的量为0.05mol,氢气的物质的量为:0.15mol,所以上a、b两级共产生气体0.2mol,标况下体积为:4.48L,而不是3.36L,故C错误;
D、a电极上尿素[CO(NH2)2]发生氧化反应,生成氮气和碳酸根离子,电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。回答以下问题:
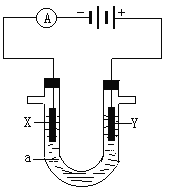
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:______________。
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是____,电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性 与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的价电子排布式为_______;上述材料中所含元素的基态原子中,未成对电子数最多的是_______ (填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)x]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是______(填元素符号);[Fe(CN)6] 4-中含有σ键与π键的数目比为_____________。
(3)K3AsO3可用于碘的微量分析。
①AsO33-的立体构型为_______,写出一种与其互为等电子体的分子_______(填化学式)。
②K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为_______。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为_______。

a.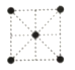 b.
b. c.
c. d.
d.
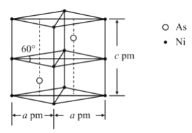
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识,分析并回答下列各小题。
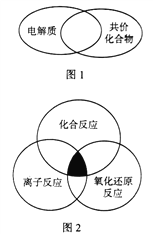
(1)下列物质属于图1所示化学概念交叉部分的有______(填标号)。
a.氨气 b.硝酸 c.乙醇 d.醋酸钠
(2)下列各反应属于图2中阴影部分所示关系的有_______(填标号)。
a.氨气与浓硝酸
b.氢气与氧气
c.氯气与氯化亚铁溶液
d.铜与氯化铁溶液
(3)下列有关说法正确的是_____(填标号)。
a.核电站把核能转化为电能
b.常温下铜与浓硫酸发生钝化。反应很快停止
c.海水中提取化学物质均涉及到氧化还原反应
d.电解法得到某元素单质,则该元素可能被还原,也可能被氧化
(4)下列各实验过程中,需要检查所用某些仪器是否漏水的有_______(填标号)。
a.氢气还原氧化铜
b.水与煤油混合物分离
c.氯化钠溶液与泥沙分离
d.配制100mL 10mol·L-1碳酸钠溶液
(5)下列关于试剂保存的叙述正确的是_________(填标号)。
a.氢氟酸保存在玻璃瓶中
b.KOH溶液保存在带玻璃塞的细口瓶中
c.溴水保存在带橡胶塞的棕色瓶中
d.KMnO4与乙醇不能放在同一药品厨中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)![]() cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是
cC(g)+dD(s);△H=QkJ·mol-1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、反应速率(v)与压强的关系如图所示。据图分析,以下说法正确的是

A. T1<T2,Q>0
B. 增大压强,B的转化率减小
C. 当反应达平衡时,混合气体的密度不再变化
D. a+b>c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:

(1)装置应盛放的试剂是I ____,IV _______(将下列有关试剂的序号填入空格内);
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是____________________________;
(3)使用装置II的目的是____________________________________ ;
(4)使用装置III的目的是 ___________________________________;
(5)确定含有乙烯的现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一 种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。
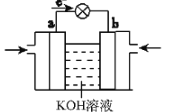
(1)W在元素周期表中的位置是______。
(2)2.24L(标准状况)XQ3被200mL 1mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是______。
(3)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______。
(4)已知:W(s)+Y2(g)═WY2(g)△H=-393.5kJ/mol WY(g)+ ![]() Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是______。
Y2(g)═WY2(g)△H=-283.0kJ/mol24g W与一定量的Y2反应,放出热量362.5kJ,所得产物的物质的量之比是______。
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电能是现代社会应用最广泛的能源之一。
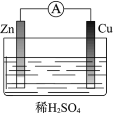
(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,气体反应物既被氧化又被还原的是
A.金属钠露置在空气中迅速变暗
B.露置在空气中的过氧化钠固体变白
C.将氨气与氯化氢混合,产生大量白烟
D.充满二氧化氮的试管倒扣在水槽中,试管内液面上升
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com