
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PI3)引用作新敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成。回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H1。
CH3NH2(g)+H2O(g) △H1。
①NH3电子式为_______。
②已知该反应中相关化学键的键能数据如下:

则该反应的△H1=_______kJ·mol-1
(2)上述反应中所需的甲醇可以利用甲烷为原料在催化剂作用下直接氧化来合成。煤炭中加氢气可发生反应:C(s)+2H2(g)![]() CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。
CH4(g) △H2。在密闭容器中投入碳和H2,控制条件使其发生该反应,测得碳的平衡转化率随压强及温度的变化关系如图中曲线所示。

①该反应的△H2_______0(填“>” 、“<”或“=”),判断理由是_______。
②在4MPa、1100K时,图中X点v正(H2)____ v逆(H2)(填“>”、“<”或“=”)。该条件下,将1molC和2molH2通入密闭容器中进行反应,平衡时测得的转化率为80%,CH4的体积分数为______。若维持容器体积不变,向其中再加入0.5mo1C和1mo1H2,再次达到平衡后,平衡常数K_____(填“增大”、“减小”或“不变”)。
③某化学兴趣小组提供下列四个条件进行上述反应,比较分析后,你选择的反应条件是______(填字母序号)。
A.5MPa 800K B.6MPa 1000K C.10MPa 1000K D.10MPa 1100K
(3)已知常温下PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,Pb(NO3)2溶液与KI溶液混合可形成PbI2沉淀。现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合,则生成沉淀所需KI溶液的最小浓度为______。
【答案】![]() —12 > 随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应 > 66.7% 不变 B 4×10-3mol·L-1
—12 > 随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应 > 66.7% 不变 B 4×10-3mol·L-1
【解析】
(1)①NH3为共价化合物;
②由反应热=反应物总键能-生成物总键能可得;
②在4MPa、1100K时,图中X点没有达到平衡,碳的转化率有增大趋势,说明反应向正反应方向进行;由题给数据建立三段式求解;
③由图可知条件为6MPa 1000K时,碳的转化率高于5MPa 800K,与10MPa 1000K和10MPa 1100K相差不大;
(3)由常温下PbI2饱和溶液中c(Pb2+)计算溶度积,再由c(Pb2+)和溶度积计算所需KI溶液的最小浓度。
(1)①NH3为共价化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②由反应热=反应物总键能-生成物总键能可得△H1=[3E(C—H)+E(C—O)+ E(H—O)+3 E(N—H)]—[3E(C—H)+E(C—N)+2E(N—H)+2E(H—O)]= E(C—O)—E(H—O)+E(N—H)—E(C—N)=(351—463+393—293)kJ·mol-1=—12kJ·mol-1,故答案为:—12;
(2)①由图可知,随着反应温度升高,碳的平衡转化率增大,说明平衡向正反应方向移动,该反应为吸热反应,故答案为:>;随着温度升高,碳的平衡转化率增大,平衡向正反应方向移动,故该反应为吸热反应;
②在4MPa、1100K时,图中X点没有达到平衡,碳的转化率有增大趋势,说明反应向正反应方向进行,则v正(H2) > v逆(H2);由题给数据建立如下三段式:
C(s)+2H2(g)![]() CH4(g)
CH4(g)
起(mol) 1 2 0
变(mol) 0.8 1.6 0.8
平(mol) 0.4 0.8
由三段式可得CH4的体积分数为![]() ;温度不变,平衡常数不变,故答案为:>;66.7%;不变;
;温度不变,平衡常数不变,故答案为:>;66.7%;不变;
③由图可知条件为6MPa 1000K时,碳的转化率高于5MPa 800K,与10MPa 1000K和10MPa 1100K相差不大,从节约能源的角度考虑6MPa 1000K是较好的选择,故答案为:B;
(3)由常温下PbI2饱和溶液中c(Pb2+)=1.0×10-3mol·L-1可知,Ksp(PbI2)=c(Pb2+)c2(I-)=1.0×10-3molL-1×(2.0×10-3mol/L)2=4×10-9,则现将浓度为2×10-3mol·L-1的Pb(NO3)2溶液与一定浓度的KI溶液等体积混合后c(Pb2+)为1×10-3mol·L-1,溶液中c(I-)=![]() =2×10-3mol·L-1,则所需KI溶液的最小浓度为2×10-3mol·L-1×2=4×10-3mol·L-1,故答案为:4×10-3mol·L-1。
=2×10-3mol·L-1,则所需KI溶液的最小浓度为2×10-3mol·L-1×2=4×10-3mol·L-1,故答案为:4×10-3mol·L-1。


科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度 2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
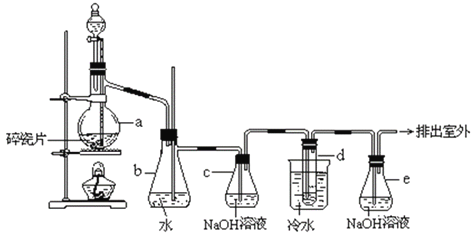
(1) 写出本题中由乙醇制备1,2-二溴乙烷的两个化学反应方程式:
①____________________________________________,反应类型为________________。
②____________________________________________,反应类型为________________。
(2)装置b可以充当安全瓶,防止倒吸,例如:若装置a、b上方气体压强减小,则装置b中的现象为________________________________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________;若无c装置,则d中发生副反应的离子方程式为________________________________________。
(4)在做此实验时,应使a装置中的液体温度迅速升高到所需温度,请用化学方程式表示其原因_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。

(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 质子数和中子数均为6的碳原子:![]() B. 硫离子的结构示意图:
B. 硫离子的结构示意图:![]()
C. 氢氧化钠的电子式:![]() D. 乙烯的结构简式:CH2CH2
D. 乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列硫燃烧时的能量变化图,判断有关热化学方程式和说法正确的是( )

A. S(s,单斜)+O2(g)===SO2(g) ΔH=+297.16 kJ·mol-1
B. S(s,正交)===S(s,单斜) ΔH=-0.33 kJ·mol-1
C. S(s,正交)+O2(g)===SO2(g) ΔH=-296.83 kJ·mol-1
D. 单斜硫的稳定性大于正交硫的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
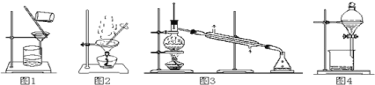
①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
②用图2所示装置从氯化钠溶液中得到氯化钠晶体
③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳
④用图4所示装置从乙醇与苯的混合物中分离出苯
A.①②B.②③C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 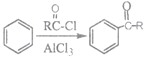
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com