
下图装置可用于( )
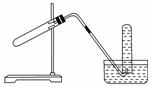
A.加热NaHCO3制CO2
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓H2SO4反应制HCl
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
| X | Y | ||
| Z | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:

(1) 混合物中MgCl2的质量为_________g,混合物中AlCl3的质量为___________g,混合物中NaOH的质量为_____________g.
(2)P点表示盐酸的体积是____________mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | C2H5OH (H2O) | 新制生石灰 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(2)用离子方程式表示E、F两种元素的非金属性强弱
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
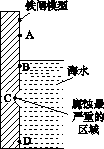
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
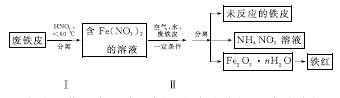
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
我国古代“药金”的冶炼方法是:将炉甘石(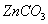 )和赤铜矿(
)和赤铜矿(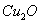 )与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”,下列叙述不正确的是( )
)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”,下列叙述不正确的是( )
A、“药金”实质上是铜锌合金
B、冶炼炉中炉甘石直接被碳还原为锌
C、用稀硫酸可区别黄金和“药金”
D、用火焰灼烧不可以区别黄金和“药金”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com