
【题目】铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。

回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外还有________。除去铁矿石中脉石(主要成分为![]() )的化学反应方程式为___________________、_____________________________;高炉排出气体的主要成分有
)的化学反应方程式为___________________、_____________________________;高炉排出气体的主要成分有![]() 、
、![]() 和_________(填化学式)。
和_________(填化学式)。
(2)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的______部分,主要反应的化学方程式为__________________;熔融造气炉相当于高炉的部分。
(3)铁矿石中常含有硫,使高炉气中混有![]() 污染空气,脱
污染空气,脱![]() 的方法是________________________________________________________________。
的方法是________________________________________________________________。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】用0.1000mol/L NaOH溶液滴定分别滴定0.1000mol/L的盐酸和醋酸溶液各25.00 mL。滴定过程中溶液pH随滴入的NaOH溶液体积变化的两条滴定曲线如图所示:
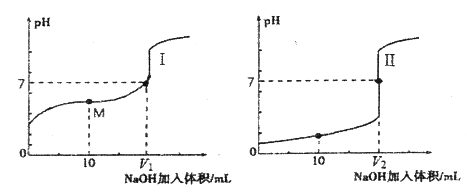
(1)滴定醋酸的曲线是_____________(填“Ⅰ”或“Ⅱ”)。
(2)下列方法中可使溶液中醋酸的电离程度减小的是_____________(填字母序号)。
A. 微热溶液 B. 加少量冰醋酸
C. 加少量醋酸钠固体 D. 加少量碳酸钠固体
(3)V1和V2的关系:V1________V2(填“>”、“=”或“<”)。
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
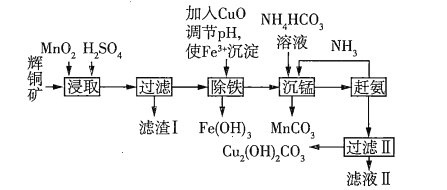
(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )

A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,其单质通常用作合金及不锈钢的添加剂,这种金属可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的主要流程:

(1)用简单氧化物形式表示![]() 的组成:____________________________。
的组成:____________________________。
(2)写出反应①的化学方程式:______________________。
(3)反应①的尾气可以再利用,写出两种利用该尾气制得的化学药品:______________________。
(4)工业上制备还原性气体的反应原理有: ,
, 。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(
。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(![]() 和
和![]() )依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知
)依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知![]() 的相对原子质量为96)
的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
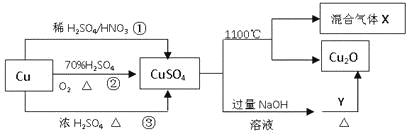
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z的氢化物稳定性Y>Z
B.Y单质的熔点高于X单质
C.X、W、Z能形成具有强氧化性的XZW
D. 中W和Y都满足8电子稳定结构
中W和Y都满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com