
【题目】25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A. 25℃时,H2A的第二步电离平衡常数约为10-6
B. 水的电离程度:N>M>P
C. 随着盐酸的不断滴入,最终溶液的pH小于2
D. P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
【答案】C
【解析】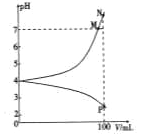
A. 25℃时,H2A的第二步电离平衡常数约为K=c(H+)c(A2-)/c(HA-)=![]() =10-6,故A正确;B. N为Na2A水解促进水电离,M点水解能力较N点弱,P为H2A抑制水电离,水的电离程度:N>M>P,故B正确;C. 随着盐酸的不断滴入,溶液无限接近0.01mol·L-1HCl,最终溶液的pH近似2,但大于2,故C错误;D. P点相当于H2A和NaCl等物质的量混合,P点时溶液中存在:电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+2c(A2-)+c(HA-),物料守恒:c(H2A)+c(HA-)+c(A2-)=c(Na+),消去c(A2-),得2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-),故D正确;故选C。
=10-6,故A正确;B. N为Na2A水解促进水电离,M点水解能力较N点弱,P为H2A抑制水电离,水的电离程度:N>M>P,故B正确;C. 随着盐酸的不断滴入,溶液无限接近0.01mol·L-1HCl,最终溶液的pH近似2,但大于2,故C错误;D. P点相当于H2A和NaCl等物质的量混合,P点时溶液中存在:电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+2c(A2-)+c(HA-),物料守恒:c(H2A)+c(HA-)+c(A2-)=c(Na+),消去c(A2-),得2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-),故D正确;故选C。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某公司设计的用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是
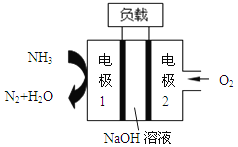
A. 电池总反应为:4NH3+3O2=2N2+6H2O
B. 电池工作时,OH-向正极移动
C. 电极 2 发生的电极反应为:O2+4H++4e-=2H2O
D. 电流由电极 1 经外电路流向电极2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是
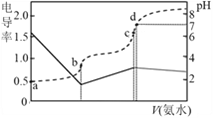
A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) > c(CH3COOH)
C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)
D. c点水的电离程度小于d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学欲利用下图所示的装置验证浓硝酸与木碳反应时有NO2、CO2生成,探究是否还有NO生成。已知二氧化氮易液化(沸点为21.1℃),而NO、CO2难液化。
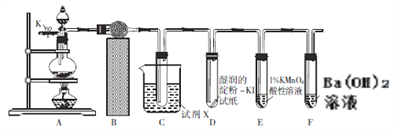
(1)装置连接好后,首先要进行的操作是_________;然后打开开关K,通过导管向装置内通入N2的目的是_________。
(2)B中的试剂是_________,C是用于检验NO2的,试剂X最好是_________(填“水”或“冰水”),D的作用是_________。
(3)若将装置C改为盛有淀粉-KI溶液的试管,也能确定有NO2生成,实验中不用此种方法的原因是_________________;假设E中溶液的颜色慢慢褪去,则E中最可能发生的反应的离子方程式为_________________;若E中没有明显的变化,C、F中出现了预期的现象,则A中反应的化学方程式为_________________。
(4)将等物质的量的NO2、NO通入冰冻的水中只可得到一种比碳酸酸性强的酸,该酸的化学式为_________,设计一种实验方案证明其酸性比碳酸的酸性强_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制240mL 0.1 molL-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_________
②配制过程中玻璃棒所起的作用是_________
③下列操作对实验结果的影响偏小的是______(填序号)
a.加水定容时俯视刻度线 b.容量瓶内壁附有水珠而未干燥处理
c.若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d. 颠倒摇匀后发现凹液面低于刻度线又加水补上
④下列为打乱了的操作示意图,请按先后顺序正确排序_______。

(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:
__FeSO4+ KMnO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
②该反应中的氧化剂是__________,氧化产物是__________
③若消耗3.16gKMnO4,则该反应转移的电子数目为______
(3)已知反应:①Cl2+2KBr=2KCl+Br2,②2KMnO4+16HCl(浓) =2KCl + 2MnCl2+ 5Cl2↑+8H2O,③Br2+K2S=2KBr+S。
①下列说法正确的是___。
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为KMnO4>Cl2>Br2>S
C.反应②中还原剂与氧化剂的物质的量之比为8:1
D.反应③中1mol还原剂被氧化则转移电子的物质的量为2mol
②用单线桥法标出反应②中电子转移的方向和数目_____。
2KMnO4+16HCl(浓) = 2KCl + 2MnCl2+ 5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属混合物3.4g,与足量的盐酸反应放出H22.24L(标况下),这两种金属可能是
A. 铜和铁 B. 镁和铝 C. 锌和铝 D. 锌和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,下列描述正确的是( )
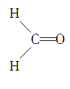
A. 甲醛分子中有4个σ键
B. 甲醛分子中的C原子为sp3杂化
C. 甲醛分子中的O原子为sp杂化
D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中有1mol NaHCO3和0.8mol Na2O2,加热充分反应后,容器内残留的固体
A. 0.5molNa2CO3和0.8mol Na2O2 B. 0.5molNa2CO3和1.6molNaOH
C. 0.8molNa2CO3和1molNaOH D. 1molNa2CO3和0.6molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com