
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: ,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.
,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.分析 由短周期元素所处的位置,可知X、Y处于第二周期,Z、W处于第三周期.
I.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,故X为N元素、Y为O元素、W为Cl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)氧元素与硫元素组成的化合物为二氧化硫与三氧化硫;
(3)高氯酸浓溶液不稳定,受热可分解,产物之一是黄绿色气体,该气体为氯气,根据电子转移守恒可知,氧元素被氧化生成氧气,由氢元素守恒,还原水生成,根据电子转移守恒计算氯气、氧气的物质的量,确定二者系数;
Ⅱ.若Y和Z的核外电子数之和为22,令Y核外电子数为a,则Z的核外电子数为a+8,故a+a+8=22,解得a=7,故Y为N元素、Z为P元素、X为C元素、W为S元素.
(1)氨气分子中N原子成3个N-H键,N原子还原1对孤对电子,据此书写电子式;工业上通常利用氮气与氢气在高温、高压催化剂条件下生成氨气;
(2)碳与浓硫酸反应生成二氧化碳、二氧化硫,根据电子转移守恒计算二者的物质的量,再根据V=nVm计算体积.
解答 解:由短周期元素所处的位置,可知X、Y处于第二周期,Z、W处于第三周期.
I.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,故X为N元素、Y为O元素、W为Cl.
(1)W为Cl元素,原子核外电子数为3,有3个电子层,最外层电子数为7,故处于周期表第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(2)氧元素与硫元素组成的化合物为:SO2、SO3,故答案为:SO2、SO3;
(3)W最高价氧化物水化物为HClO4,其浓溶液不稳定,受热可分解,产物之一是黄绿色气体,即有氯气生成,溶液中Cl元素化合价降低,则氧元素化合价升高得到氧气,且当有28mol电子转移时,共产生9mol气体,生成氯气为$\frac{28mol}{14}$=2mol,则生成氧气为7mol,该反应的化学方程式为:4HClO4$\frac{\underline{\;\;△\;\;}}{\;}$2Cl2↑+7O2↑+2H2O,故答案为:4HClO4$\frac{\underline{\;\;△\;\;}}{\;}$2Cl2↑+7O2↑+2H2O;
Ⅱ.若Y和Z的核外电子数之和为22,令Y核外电子数为a,则Z的核外电子数为a+8,故a+a+8=22,解得a=7,故Y为N元素、Z为P元素、X为C元素、W为S元素.
(1)Y的气态氢化物为NH3,电子式为 ,业合成该物质的化学方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,故答案为:
,业合成该物质的化学方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,故答案为: ;N2+3H2$?_{催化剂}^{高温高压}$2NH3;
;N2+3H2$?_{催化剂}^{高温高压}$2NH3;
(2)碳与浓硫酸反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,当电子转移0.4mol时,参加反应的碳为$\frac{0.4mol}{4}$=0.1mol,由方程式可知生成气体为0.3mol,则产生气体的体积(标准状况下)是 0.3mol×22.4L/mol=6.72L,故答案为:6.72L.
点评 本题考查结构性质位置关系、常用化学用语、元素化合物性质、化学计算等,推断元素是解题的关键,旨在考查学生对基础知识的理解掌握,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 把40gNaOH溶解于1L水中即得到1mol/L的NaOH溶液 | |
| B. | 将4.48LNH3溶解于水配成1L溶液即得到0.2mol/L的氨水溶液 | |
| C. | 配制0.2mol/L的CuSO4溶液480mL,需硫酸铜晶体的质量为25g | |
| D. | 配制1L0.2mol/L的H2SO4溶液,加水定容时仰视刻度线操作,则配出浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂1mol A-A键和1mol B-B键能放出xkJ的能量 | |
| C. | 断裂2mol A-B键需要吸收ykJ的能量 | |
| D. | 2mol AB的总能量高于1 mol A2和1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的是七个基本物理量之一 | B. | 阿伏加德罗常数是没有单位的 | ||
| C. | 1mol氮气的体积是22.4L | D. | 1mol H2O含有1个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
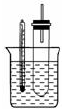 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究查看答案和解析>>
科目:高中化学 来源: 题型:多选题
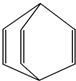
| A. | 桶烯能在NaOH水溶液中发生加成反应 | |
| B. | 桶烯中的一个氢原子被氯原子取代,所得产物有2种 | |
| C. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| D. | 桶烯在一定条件下能发生缩聚反应形成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | 平衡常数K | 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 | Br2+H2?2HBr | 1.9×1019 |
| Cl2+H2?2HCl | 2.6×1033 | I2+H2?2HI | 8.7×102 |
| A. | X2与H2反应的反应速率依次减小 | B. | F2的转化率最大 | ||
| C. | X2与H2反应的剧烈程度逐渐减弱 | D. | 升高温度,平衡常数都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com