
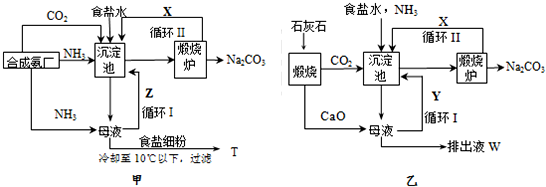
分析 (1)依据甲流程生产纯碱的方法称联合制碱法;
(2)甲流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵;
(3)依据两个过程中的物质发生的反应分析,甲流程母液主要是氯化铵、碳酸钠、碳酸氢钠、氯化钠;乙流程排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙、氨气;
(4)甲流程生产流程图中循环Ⅰ是将母液中氯化钠再次循环利用;乙流程氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气;
(5)依据乙流程中反应的化学方程式计算,根据反应生成碳酸钠的质量计算实际消耗氨气的物质的量,得到氨气的利用率;
(6)根据要制取硝酸钙(Ca(NO3)2•4H2O),则需得到Ca(NO3)2溶液即用硝酸与碳酸钙反应制得,所以首先应得到碳酸钙沉淀,据此分析.
解答 解:(1)依据甲流程生产纯碱的方法称联合制碱法,故答案为:联合制碱;
(2)甲流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,发生反应的化学方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(3)依据两个过程中的物质发生的反应分析,甲流程母液主要是氯化铵、氯化钠,经过循环Ⅰ后,再加入食盐再冷却至10℃以下,过滤得到T是NH4Cl;乙流程排出液中的溶质除了氢氧化钙外,还有氢氧化钙和氯化铵反应生成的氯化钙、氨气,其中氨气循环利用,所以W中除Ca(OH)2外,溶质的主要成分是CaCl2,故答案为:NH4Cl;CaCl2;
(4)甲流程生产流程图中循环Ⅰ是将母液中氯化钠再次循环利用,所以甲流程中设计循环I的目的是提高食盐的利用率;乙流程氨碱法的生产流程中循环Ⅰ是氧化钙和水反应生成氢氧化钙与铵盐反应生成的氨气,所以乙流程中设计循环I的目的是提高氨气的利用率,故答案为:提高食盐的利用率;提高氨气的利用率;
(5)在乙流程中发生的反应为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3═Na2CO3+H2O+CO2↑;每当通入NH3 44.8L(已折合成标准状况下)物质的量为2mol;又生产过程中得到纯碱100.0g,物质的量为$\frac{100g}{106g/mol}$=$\frac{50}{53}$mol,则需要氨气的物质的量为$\frac{50}{53}$×2=$\frac{100}{53}$mol;则NH3的利用率=$\frac{\frac{100}{53}}{2}$×100%=94.3%;
故答案为:94.3%;
(6)首先向氯化钙废液中加入足量的碳酸钠固体过滤得到碳酸钙沉淀,然后向沉淀中滴加入稀硝酸直到沉淀刚好溶解为止,最后将溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥得到Ca(NO3)2•4H2O晶体,流程图表示为氯化钙废液$\stackrel{Na_{2}CO_{3}}{→}$$\stackrel{过滤}{→}$CaCO3沉淀$\stackrel{HNO_{3}}{→}$Ca(NO3)2溶液$\stackrel{蒸发浓缩}{→}$$\stackrel{冷却结晶}{→}$$\stackrel{过滤}{→}$$\stackrel{洗涤}{→}$$\stackrel{干燥}{→}$Ca(NO3)2•4H2O晶体,故答案为:CaCl2废液$\stackrel{Na_{2}CO_{3}}{→}$$\stackrel{过滤}{→}$CaCO3沉淀$\stackrel{HNO_{3}}{→}$Ca(NO3)2溶液$\stackrel{蒸发浓缩}{→}$$\stackrel{冷却结晶}{→}$$\stackrel{过滤}{→}$$\stackrel{洗涤}{→}$$\stackrel{干燥}{→}$Ca(NO3)2•4H2O晶体.
点评 本题考查了联碱法和氨碱法生产流程的原理比较和物质分析判断,纯碱制备的条件应用和服产物的提纯析出,反应过程中反应的原理分析和物质来源是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
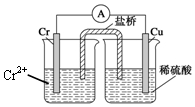 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )| A. | 盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液 | |
| B. | 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 | |
| C. | 此过程中H+得电子,发生氧化反应 | |
| D. | 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 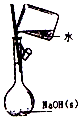 配制0.10mol/L NaOH溶液 | |
| B. | 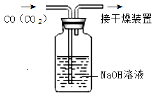 除去CO中的CO2 | |
| C. | 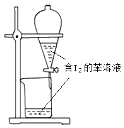 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 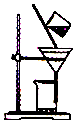 除去粗盐溶液中的不溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
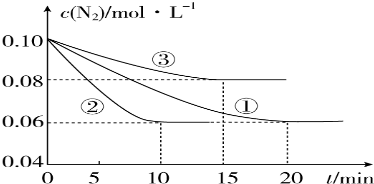
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com