
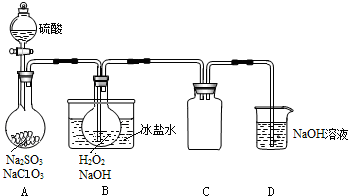
分析 (1)固体配制溶液,计算后称量固体,在烧杯中溶解、冷却即可;
(2)亚硫酸钠和NaClO3均会和硫酸发生反应,NaClO3过量,防止生成二氧化硫;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,Cl元素的化合价降低,则另一种阴离子中Cl元素的化合价大于+4价;
(5)B中ClO2气体在碱性环境下,能将过氧化氢氧化,得到ClO2-;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可;
(7)装置C作为安全瓶,可防止液体倒吸;
(8)由Na元素守恒可知存在NaClO3~NaClO2•3H2O,结合m=nM计算;
(9)ClO2将CN-氧化,只生成两种无毒气体,即氮气和二氧化碳,结合2ClO2+2CN-=2CO2+2Cl-+N2↑计算.
解答 解:(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、量筒、天平,故答案为:量筒;天平;
(2)亚硫酸钠和NaClO3均会和硫酸发生反应,实验须使NaClO3稍微过量,其目的是使Na2SO3完全反应,避免产生SO2气体,
故答案为:使Na2SO3完全反应,避免产生SO2气体;
(3)为使ClO2气体能被均匀、充分吸收,需要控制物质的量以及产生的速率,可以控制硫酸的滴入速度,故答案为:控制硫酸的滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,
故答案为:ClO3-;
(5)ClO2气体在碱性环境下能将过氧化氢氧化,得到ClO2-,B中反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2↑;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,故答案为:②;⑤⑥;
(7)装置C的作用是防倒吸,故答案为:防倒吸;
(8)28.9 g NaClO2•3H2O的物质的量是$\frac{28.9g}{144.5g/mol}$=0.2mol,根据钠元素守恒需要的NaClO3的物质的量是$\frac{0.2mol}{80%}$=0.25mol,所以需要NaClO3的质量是0.25mol×106.5g/mol≈26.6g,故答案为:26.6;
(9)用ClO2将CN-氧化,生成氮气和二氧化碳两种无毒气体的化学方程式为2ClO2+2CN-=2CO2+2Cl-+N2↑,amg/L这种污水中含有CN-的质量是100ag,CN-的物质的量为$\frac{100ag}{26g/mol}$=$\frac{50a}{13}$mol,所以需要ClO2的物质的量是$\frac{50a}{13}$mol,故答案为:$\frac{50a}{13}$.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、溶液配制、氧化还原反应、实验技能为解答关键,侧重分析与实验能力的考查,注意结合守恒法及反应计算,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
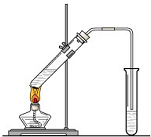 实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:
实验室我们可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
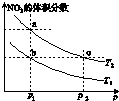 在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点的反应速率:a>c | B. | 由a点到b点,可以用加热的方法 | ||
| C. | a、c两点气体的颜色:a深,c浅 | D. | a、b两点NO2的转化率:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
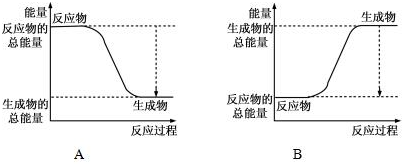
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 加催化剂 | |
| C. | 保持体积不变,充入氮气使体系压强增大 | |
| D. | 保持压强不变,充入氮气使容器体积增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com