
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3两种工艺的流程如下:
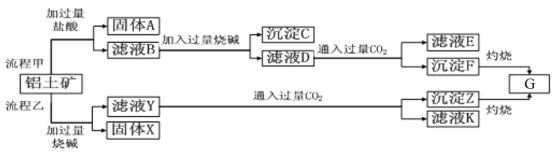
请回答下列问题:
(1)流程乙加入烧碱后和SiO2反应的离子方程式为________________________________。
(2)流程甲滤液D中通入过量CO2的化学方程式为_______________________________。
(3)验证滤液B中是否含有Fe3+的方法:_____________________________。
(4)写出滤液E中溶质的一种用途_________________________________。
(5)由物质G制取铝的化学方程式为__________________________。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移3mole-,有1.5mol化合物X生成,此反应的化学方程式________。
【答案】 SiO2+2OH-=SiO32-+H2O NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3 取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+ 制纯碱或做发酵粉等 2Al2O3![]() 4Al+3O2↑ Al2O3+N2+3C
4Al+3O2↑ Al2O3+N2+3C![]() 2AlN+3CO
2AlN+3CO
【解析】由工艺流程甲可知,铝土矿与盐酸反应得固体A、滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为A1(OH)3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为A1(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答。
(1)根据以上分析可知流程乙加入烧碱后和SiO2反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)流程甲滤液D中通入过量CO2生成氢氧化铝和碳酸氢钠,反应的化学方程式为NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3。
(3)一般用KSCN溶液检验铁离子,则验证滤液B含Fe3+方法为取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;
(4)滤液E中含有NaCl、NaHCO3,碳酸氢钠可制纯碱或做发酵粉等。
(5)铝是活泼的金属,通过电解熔融的氧化铝制得,氢氧化铝受热分解生成G是氧化铝,则制备铝的方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X,根据元素守恒可知X中应含有氧元素和碳元素,已知每转移3mole-,有1.5mol化合物X生成,由电子转移守恒可得在X中C的化合价为3mol÷1.5mol=2,所以X是CO,因此该反应的化学方程式为Al2O3+N2+3C![]() 2AlN+3CO。
2AlN+3CO。


科目:高中化学 来源: 题型:
【题目】海水中含有的氯化镁是镁的重要来源之一。从海水中制取镁有多种生产方法,可按如下步骤进行:
①把贝壳制成石灰乳
②在引入的海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解
关于从海水中提取镁的下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富
B. 进行①②③步骤的目的是从海水中提取氯化镁
C. 以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
D. 第④步电解制镁是由于镁是很活泼的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知E1=134kJ/mol、E2=368kJ/mol,请参考题中图表,按要求填空: 
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,NO2和CO反应的热化学方程式为: .
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应. 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3= .
(3)下表所示是部分化学键的键能参数:
化学键 | P﹣P | P﹣O | O═O | P═O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热为d kJ/mol,白磷及其完全燃烧生成的产物的结构如图Ⅱ所示,表中x= kJ/mol(用含a、b、c、d的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中不正确的是
A. 0.5 mol由F2与Ar组成的混合气体中含质子总数为9NA
B. 标准状况下,足量Na2O2与5.6 L CO2反应转移电子数目为0.25NA
C. 71g Cl2通入水中,HClO、ClO-、Cl-三种微粒数目之和为2NA
D. 常温下,1.5 L 1.0 mol L-1 CuSO4溶液中阳离子数目大于1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关氧化还原反应的叙述正确的是( )
A.在反应中不一定所有元素的化合价都发生变化
B.肯定有一种元素被氧化,另一种元素被还原
C.非金属单质在反应中只做氧化剂
D.某元素从化合物变为单质时,该元素一定被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN 度液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN 的电离常数Ka=62×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN 溶解于一定浓度的NaOH 溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_________________。
(3)系列操作B 为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移 向 催 化 剂___________(填“a”或“b”)。
②催化剂a 表面发生的反应为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com