
【题目】在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g。则:
(1)混合气体的密度是_______。(结果保留两位小数)
(2)CO和CO2的物质的量之比是________。
(3)CO的体积分数是________,CO的质量分数是________。
(4)混合气体中所含氧原子的物质的量是_________,所含碳原子的物质的量是_________。
(5)混合气体的平均摩尔质量是_________,对氢气的相对密度是__________。
【答案】1.79 g·L-1 1∶3 25% 17.5% 0.525 mol 0.3 mol 40 g·mol-1 20
【解析】
设CO、CO2的物质的量分别为x、y。由题意得:
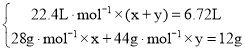 ,解得x=0.075 mol,y=0.225 mol。
,解得x=0.075 mol,y=0.225 mol。
(1)混合气体的密度是![]() ≈1.79 g·L-1。
≈1.79 g·L-1。
(2)n(CO)∶n(CO2)=0.075 mol∶0.225 mol=1∶3。
(3)CO的体积分数为25%,CO的质量分数为![]() ×100%=17.5%。
×100%=17.5%。
(4)混合气体中所含氧原子的物质的量为0.075 mol+0.225 mol×2=0.525 mol,所含碳原子的物质的量为0.075 mol+0.225 mol=0.3 mol。
(5)混合气体的平均摩尔质量是![]() =40 g·mol-1,对氢气的相对密度为20。
=40 g·mol-1,对氢气的相对密度为20。


科目:高中化学 来源: 题型:
【题目】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为________,电负性由大到小的顺序为________________________。
(3)H2O 与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是______________________。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________,所含共价键的类型为_____________,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_____________________。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
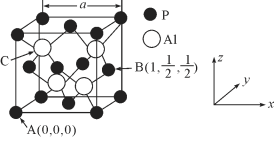
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________。
③磷化铝的晶胞参数a=546.35pm,其密度为_____________(列出计算式即可,用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. a点由水电离出的c(H+)=1.0×10-14 mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH4+)
D. d点前,溶液温度上升的主要原因是NH3·H2O电离放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1999年比利时发生奶粉受二噁英污染事件。二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一,2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图,下列说法中不正确的是 ( )
![]()
A. 它的分子式为C12H4O2Cl4B. 它不能发生加成反应
C. 它的一溴取代物有一种D. 此分子中共平面的原子最多有22个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如下的烃,下列说法正确的是 ( )
① ![]() 和
和![]() 是同分异构体 ②
是同分异构体 ② ![]() 和
和![]() 是同系物
是同系物
③ ![]() 和
和![]() 都能发生加成反应 ④
都能发生加成反应 ④![]() 、
、![]() 、
、![]() 、
、![]() 都能发生取代反应
都能发生取代反应
A. ①④B. ①②C. ①②③D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
完成下列填空。
(1)A的原子最外层电子排布式为______,该电子层内含______种不同运动状态的电子。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:______。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是______。写出该化合物在实验室制备乙酸乙酯时所起的作用:______。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式___。写出实验室检验溶液中该离子的简单实验方案:_______。
(4)元素A与元素D相比,非金属性较强的是______(用元素符号表示),下列表述中能表明这一事实的是_______。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于________晶体,该氢化物与少量A的最高价氧化物水化物反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO俗称锌白,能改进玻璃的化学稳定性,可用于生产特种玻璃。工业上由粗锌![]() 含FeO、CuO等
含FeO、CuO等![]() 制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:
制备ZnO,采取酸浸入、净化除杂、中和沉淀、干燥等步骤,工艺如下:

![]() 该流程中物质X可以是下列中的 ________________
该流程中物质X可以是下列中的 ________________
A.ZnO B.NaOH C.Zn(OH)2 D.Na2CO3
![]() 已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐
已知ZnO为两性氧化物,与氢氧化钠溶液反应可生成可溶性的锌酸盐![]() ,写出反应的离子方程式_________________________;
,写出反应的离子方程式_________________________;
![]() 写出加入
写出加入![]() 时发生反应的离子方程式 _________________________________;
时发生反应的离子方程式 _________________________________;
![]() 加锌粉过滤得到的滤渣主要成分是_________
加锌粉过滤得到的滤渣主要成分是_________
![]() 上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器:_________;
上述流程中多次用到了过滤操作,请写出过滤时用到的玻璃仪器:_________;
![]() 检验滤液A中溶质的阴离子的方法是________________________________。
检验滤液A中溶质的阴离子的方法是________________________________。
![]() 取碱式碳酸锌水合物
取碱式碳酸锌水合物![]() ,溶于盐酸中生成二氧化碳
,溶于盐酸中生成二氧化碳![]() 标况下
标况下![]() ,溶解过程消耗氯化氢
,溶解过程消耗氯化氢![]() ,若该碱式盐中氢元素的质量分数为
,若该碱式盐中氢元素的质量分数为![]() ,试推测该碱是碳酸锌水合物的化学式是__________________。
,试推测该碱是碳酸锌水合物的化学式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。

已知:i.PbCl2微溶于水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)△H>0
PbCl42-(aq)△H>0
(1)浸取过程中MnO2与PbS发生如下反应,请将离子反应补充完整并配平:_____
______+___Cl-+___PbS+___MnO2=___PbCl2+__SO42-+_____ +_____
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__________。
(3)调pH的目的是____________。
(4)沉降池中获得PbCl2采取的措施有_________。
(5)通过电解酸性废液可重新获得MnO2,装置示意图如下:
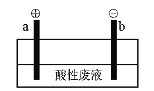
①在_____极(填“a”或“b”)获得MnO2,电极反应为_______________。
②电解过程中发现有Cl2产生,原因可能是_____________(用化学用语表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.4g Fe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到30g Fe(NO3)2和Fe(NO3)3的混合物,将该固体隔绝空气在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中得到硝酸和NO,在标准状况生成NO气体的体积为
A. 1120mL B. 2240mL C. 3360mL D. 4480mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com