
【题目】有机物C是一种药物的中间体,其合成路线如下图所示:
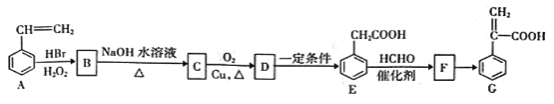
已知:①CH3CH=CH2+HBr![]() CH3CH2CH2Br
CH3CH2CH2Br
②CH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
回答下列问题:
(1)F中含氧官能团的名称为_______。
(2)C→D的化学方程式为_______。
(3)D→E、E→F的反应类型分别为_______、_______;F→G的反应条件为_______。
(4)下列说法正确的是_______(填标号)。
a. A中所有原子可能都在同一平面上
b. B能发生取代、加成、消去、缩聚等反应
c.合成路线中所涉及的有机物均为芳香族化合物
d.一定条件下1mol有机物G最多能与4molH2发生反应
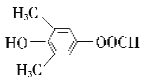
(5)化合物F有多种同分异构体,其中同时满足下列条件的同分异构体的结构简式为应_______。
① 属于芳香族化合物,且含有两个甲基;
② 能发生水解反应和银镜反应;
③ 能与FeCl3发生显色反应;
④ 核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1。
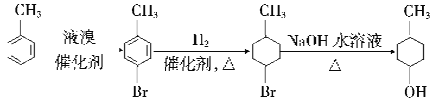
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位。根据题中的信息,以甲苯为原料合成有机物![]() ,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
![]()
【答案】 羟基、羧基 ![]() 氧化反应 加成反应 浓硫酸、加热 ad
氧化反应 加成反应 浓硫酸、加热 ad 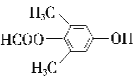 、
、
【解析】根据已知信息①可知苯乙烯与溴化氢反应生成B是![]() ,B水解生成C是
,B水解生成C是![]() ,C发生催化氧化生成D是
,C发生催化氧化生成D是![]() ,D继续发生氧化反应生成E,根据已知信息②可知E和甲醛反应生成F是
,D继续发生氧化反应生成E,根据已知信息②可知E和甲醛反应生成F是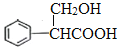 ,F发生消去反应生成G。
,F发生消去反应生成G。
(1)F是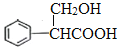 ,分子中含氧官能团的名称为羟基、羧基。(2)C→D的化学方程式为2
,分子中含氧官能团的名称为羟基、羧基。(2)C→D的化学方程式为2![]() +O2
+O2![]() 2
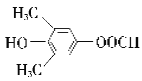
2![]() +2H2O;(3)根据以上分析可知D→E、E→F的反应类型分别为氧化反应、加成反应;F→G是羟基的消去反应,反应条件为浓硫酸、加热。(4)a. 苯环和碳碳双键均是平面形结构,则A中所有原子可能都在同一平面上,a正确;b. B中含有溴原子、苯环,能发生取代、加成、消去等反应,不能发生缩聚反应,b错误;c.合成路线中甲醛不是芳香族化合物,c错误;d.G分子中含有碳碳双键和苯环,一定条件下1mol有机物G最多能与4molH2发生反应,d正确,答案选ad;(5)①属于芳香族化合物,说明含有苯环,且含有两个甲基;②能发生水解反应和银镜反应,因此含有甲酸形成的酯基;③能与FeCl3发生显色反应,含有酚羟基;④核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1,因此符合条件的有机物结构简式为
+2H2O;(3)根据以上分析可知D→E、E→F的反应类型分别为氧化反应、加成反应;F→G是羟基的消去反应,反应条件为浓硫酸、加热。(4)a. 苯环和碳碳双键均是平面形结构,则A中所有原子可能都在同一平面上,a正确;b. B中含有溴原子、苯环,能发生取代、加成、消去等反应,不能发生缩聚反应,b错误;c.合成路线中甲醛不是芳香族化合物,c错误;d.G分子中含有碳碳双键和苯环,一定条件下1mol有机物G最多能与4molH2发生反应,d正确,答案选ad;(5)①属于芳香族化合物,说明含有苯环,且含有两个甲基;②能发生水解反应和银镜反应,因此含有甲酸形成的酯基;③能与FeCl3发生显色反应,含有酚羟基;④核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1,因此符合条件的有机物结构简式为 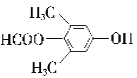 、
、 。(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位。根据题中的信息结合逆推法可知以甲苯为原料合成有机物
。(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位。根据题中的信息结合逆推法可知以甲苯为原料合成有机物![]() 的合成路线图
的合成路线图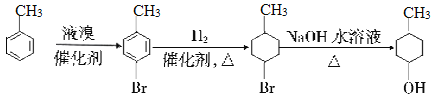 。
。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是( )

A. 该装置为原电池,且铜为负极
B. 电池工作时,H+向Cu电极移动
C. GaN电极表面的电极反应式为2H2O-4e-===O2+4H+
D. 反应CO2+2H2O![]() CH4+2O2中每消耗1 mol CO2转移4 mol e-
CH4+2O2中每消耗1 mol CO2转移4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B. PH3和CH4都是正四面体形分子且键角都为109°28′
C. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸牛奶中含有乳酸,乳酸具有帮助消化、增进食欲的功能,其结构简式为: 。下列关于乳酸的说法错误的是
。下列关于乳酸的说法错误的是
A. 1mol乳酸与足量金属钠反应生成lmolH2
B. 既是乙醇的同系物,又是乙酸的同系物
C. 可与乙醇、乙酸反应,且反应类型相同
D. 与有机物HOCH2CH2COOH互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HNO3是挥发性一元强酸
B. Al2O3既是金属氧化物,也是碱性氧化物
C. 氧气和臭氧的相互转化是物理变化
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NaHSO4的说法中正确的是( )
A.NaHSO4固体溶于水时既破坏离子键又破坏共价键
B.NaHSO4固体熔化时破坏的是离子键和共价键
C.NaHSO4固体中阳离子和阴离子的个数比为2:1
D.NaHSO4晶体是离子晶体,因此能够导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。

(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z、R、Q为前四周期元素,且原子序数依次增大。A是所有元素中原子半径最小的;B的核外电子排布式为ls22s22p2;X原子单电子数在同周期元素中最多;Y与X同周期,第一电离能比X的低;Z的M层电子数是K层电子数的2倍;R与Y同主族;Q的最外层只有一个电子,其它电子层电子均处于饱和状态。
回答下列问题:
(1)Q+的核外电子排布式为______,Z的价电子轨道表达式(价电子排布图)为_______。
(2)化合物XA3中X原子的杂化方式为______;A3Y+的立体构型为______。
(3)① B、Z的最高价氧化物的沸点较高的是______(填化学式),原因是______。
② Y与R的简单氢化物中Y的熔沸点更高,原因是______。
(4)向Q元素的硫酸盐溶液中通入足量XA3,充分反应后溶液呈深蓝色,该反应的离子方程式为______。
(5)B有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞中B原子数为______,B原子的配位数为______,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加德罗常数为______(用含a和p的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②H2CO3 | ③NaOH ④Ba(OH)2 | ⑤NaHSO4 ⑥_________ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩__________ |
(1)请仔细观察表格中的物质类别,从H、O、C、N四种元素中任选两种或三种组成合适的物质,将化学式分别填在表中⑥、⑩后面的横线上(各写一种)。
(2)写出①和④反应的离子方程式:___________________________________________。
(3)⑦与CO2都属于酸性氧化物,写出少量⑦通入③的溶液中反应的离子方程式_____________。
(4)①和⑤都易溶于水并电离出SO![]() ,检验溶液中SO
,检验溶液中SO![]() 的方法是____________________。
的方法是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com