
【题目】如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。

(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
【答案】 D 4 原子 E 2 A 12 C 离子 8 B 分子 12 石墨>金刚石>NaCl>CsCl>干冰
【解析】(1)在金刚石晶胞中,每个碳可与周围4个碳原子形成共价键,将这4个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图D为金刚石,每个碳原子与4个碳原子最近且距离相等;金刚石是空间网状结构,属于原子晶体,故答案为:D,4,原子;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形,所以图E为石墨的结构,每个正六边形占有的碳原子数平均为6×![]() =2;故答案为:E,2;
=2;故答案为:E,2;
(3)在NaCl晶胞中,每个钠离子周围有六个氯离子,每个氯离子周围也有六个钠离子,所以图A为NaCl的结构,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有八个这样的立方体,所以每个钠离子周围与它最近且距离相等的钠离子就有12个;故答案为:A,12;
(4)CsCl的晶胞中铯离子和氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围也有8个铯离子,所以图C为CsCl的结构,属于离子晶体;故答案为:C,离子;8;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体;故答案为:B,分子;12;
(6)各种物质的熔点:原子晶体>离子晶体>分子晶体,石墨的熔点大于金刚石,在离子晶体里,半径越大,晶格能越小,熔点越低,由于铯离子半径大于钠离子,石墨的熔点大于金刚石,所以熔点由高到低的排列顺序为:石墨>金刚石>NaCl>CsCl>干冰;故答案为:石墨>金刚石>NaCl>CsCl>干冰。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
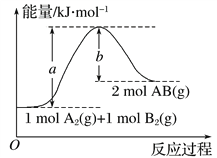
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为________________。
(2) N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)===N2(g)+2H2O(l)的ΔH=____________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_______________________________________。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为____________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择_____________mol·L-1的NaOH溶液进行实验。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C是一种药物的中间体,其合成路线如下图所示:
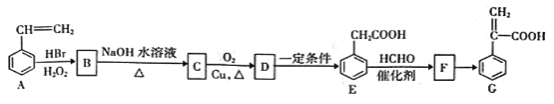
已知:①CH3CH=CH2+HBr![]() CH3CH2CH2Br
CH3CH2CH2Br
②CH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
回答下列问题:
(1)F中含氧官能团的名称为_______。
(2)C→D的化学方程式为_______。
(3)D→E、E→F的反应类型分别为_______、_______;F→G的反应条件为_______。
(4)下列说法正确的是_______(填标号)。
a. A中所有原子可能都在同一平面上
b. B能发生取代、加成、消去、缩聚等反应
c.合成路线中所涉及的有机物均为芳香族化合物
d.一定条件下1mol有机物G最多能与4molH2发生反应
(5)化合物F有多种同分异构体,其中同时满足下列条件的同分异构体的结构简式为应_______。
① 属于芳香族化合物,且含有两个甲基;
② 能发生水解反应和银镜反应;
③ 能与FeCl3发生显色反应;
④ 核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位。根据题中的信息,以甲苯为原料合成有机物![]() ,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是
A. 升高 B. 降低 C. 不变 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硬脂酸甘油酯是天然高分子化合物
B.葡萄糖在酒化酶催化下,可以水解为乙醇,这是酿酒的原理
C.浓的硫酸钠溶液加入鸡蛋清中,蛋白质变性而凝聚
D.“离离原上草,一岁一枯荣”,小草富含纤维素,可以用来造纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HF的热稳定性很好,是因为HF分子间存在氢键
B. 构成单质分子的粒子之间不一定存在共价键
C. 由非金属元素组成的化合物不一定是共价化合物
D. 阴、阳离子间通过离子键一定能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下表所示。X元素最常见价态氢化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物。下列说法正确的是
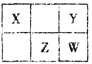
A. 简单离子半径:W>Z>Y
B. 简单气态氢化物的稳定性:Y >Z > W
C. 最高价氧化物对应的水化物酸性:W >Z
D. 若W的最高正价为+ m,则Y的最高正价也一定为+m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com