
【题目】A、B、X、Y、Z、R、Q为前四周期元素,且原子序数依次增大。A是所有元素中原子半径最小的;B的核外电子排布式为ls22s22p2;X原子单电子数在同周期元素中最多;Y与X同周期,第一电离能比X的低;Z的M层电子数是K层电子数的2倍;R与Y同主族;Q的最外层只有一个电子,其它电子层电子均处于饱和状态。
回答下列问题:
(1)Q+的核外电子排布式为______,Z的价电子轨道表达式(价电子排布图)为_______。
(2)化合物XA3中X原子的杂化方式为______;A3Y+的立体构型为______。
(3)① B、Z的最高价氧化物的沸点较高的是______(填化学式),原因是______。
② Y与R的简单氢化物中Y的熔沸点更高,原因是______。
(4)向Q元素的硫酸盐溶液中通入足量XA3,充分反应后溶液呈深蓝色,该反应的离子方程式为______。
(5)B有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞中B原子数为______,B原子的配位数为______,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加德罗常数为______(用含a和p的式子表示)。

【答案】 ls22s22p63s23p63dl0 ![]() sp3 三角锥形 SiO2 SiO2为原子晶体,CO2固体为分子晶体 水分子间存在氢键,而H2S分子间只存在范德华力 Cu2++4NH3= [Cu(NH3)4]2+或Cu2++4NH3·H2O=[ Cu(NH3)4]2++4H2O 8 【答题空10】4
sp3 三角锥形 SiO2 SiO2为原子晶体,CO2固体为分子晶体 水分子间存在氢键,而H2S分子间只存在范德华力 Cu2++4NH3= [Cu(NH3)4]2+或Cu2++4NH3·H2O=[ Cu(NH3)4]2++4H2O 8 【答题空10】4 ![]()
【解析】A、B、X、Y、Z、R、Q为前四周期元素,且原子序数依次增大。A是所有元素中原子半径最小的,则A为H元素;B的核外电子排布为1s22s22p2,故B为C元素;Z的M层电子数是K层电子数的2倍,Z是Si;X原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于Si,Y与X同周期,第一电离能比X的低,则X是N,Y是O;R与Y同主族,R是S;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Q为Cu元素,则
(1)Cu+核外电子排布式为:1s22s22p63s23p63d10;Si的价电子轨道表达式(价电子排布图)为![]() ;(2)化合物NH3是三角锥形结构,N元素含有一对孤对电子,N原子的杂化方式为sp3杂化;H3O+中中心原子的价层电子对数是
;(2)化合物NH3是三角锥形结构,N元素含有一对孤对电子,N原子的杂化方式为sp3杂化;H3O+中中心原子的价层电子对数是![]() ,含有一对孤对电子,其立体构型为三角锥形。(3)①B、Z的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是 SiO2;②由于水分子间存在氢键,而H2S分子间只存在范德华力,因此水的沸点更高;(4)向硫酸铜溶液中通入氨气,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O;(5)碳有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的C原子数为:4+8×1/8+6×1/2=8;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为a pm,则晶胞体积为(a×10-10)3cm3,晶体的密度为ρ g/cm3,则晶胞质量为(a×10-10)3cm3×ρ g/cm3=ρa3×10-30ρ g,则8×12/NAg=ρa3×10-30ρ g,故NA=96×1030/a3ρmol-1。
,含有一对孤对电子,其立体构型为三角锥形。(3)①B、Z的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是 SiO2;②由于水分子间存在氢键,而H2S分子间只存在范德华力,因此水的沸点更高;(4)向硫酸铜溶液中通入氨气,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O;(5)碳有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的C原子数为:4+8×1/8+6×1/2=8;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为a pm,则晶胞体积为(a×10-10)3cm3,晶体的密度为ρ g/cm3,则晶胞质量为(a×10-10)3cm3×ρ g/cm3=ρa3×10-30ρ g,则8×12/NAg=ρa3×10-30ρ g,故NA=96×1030/a3ρmol-1。


科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备 ClO2 的流程如下:
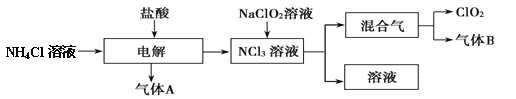
(1)ClO2 中所有原子_____(填“是”或“不是”)都满足 8 电子结构。上图所示方法制得的混合气中杂质气体 B 能使石蕊试液显蓝色,除去该杂质气体可选用_____;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是_____;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离, 还可能污染环境。写出该方法发生的化学方程式_____;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是______,此法相比欧洲方法的优点是_____。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____,此法提高了生产及储存、运输的安全性,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物C是一种药物的中间体,其合成路线如下图所示:
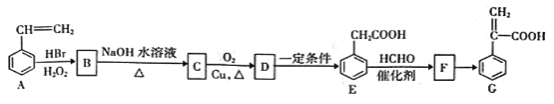
已知:①CH3CH=CH2+HBr![]() CH3CH2CH2Br
CH3CH2CH2Br
②CH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
回答下列问题:
(1)F中含氧官能团的名称为_______。
(2)C→D的化学方程式为_______。
(3)D→E、E→F的反应类型分别为_______、_______;F→G的反应条件为_______。
(4)下列说法正确的是_______(填标号)。
a. A中所有原子可能都在同一平面上
b. B能发生取代、加成、消去、缩聚等反应
c.合成路线中所涉及的有机物均为芳香族化合物
d.一定条件下1mol有机物G最多能与4molH2发生反应
(5)化合物F有多种同分异构体,其中同时满足下列条件的同分异构体的结构简式为应_______。
① 属于芳香族化合物,且含有两个甲基;
② 能发生水解反应和银镜反应;
③ 能与FeCl3发生显色反应;
④ 核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位。根据题中的信息,以甲苯为原料合成有机物![]() ,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
,请设计合成路线:_______(无机试剂及溶剂任选)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硬脂酸甘油酯是天然高分子化合物
B.葡萄糖在酒化酶催化下,可以水解为乙醇,这是酿酒的原理
C.浓的硫酸钠溶液加入鸡蛋清中,蛋白质变性而凝聚
D.“离离原上草,一岁一枯荣”,小草富含纤维素,可以用来造纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列对应关系正确的是
选项 | 性质 | 实际应用 |
A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
B | SO2具有还原性 | 漂白纸浆 |
C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暧宝贴 |
D | 氧化铝是两性氧化物 | 作耐高温材料 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HF的热稳定性很好,是因为HF分子间存在氢键
B. 构成单质分子的粒子之间不一定存在共价键
C. 由非金属元素组成的化合物不一定是共价化合物
D. 阴、阳离子间通过离子键一定能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
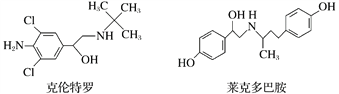
A. 克伦特罗分子的分子式为C12H18ON2Cl2
B. 克伦特罗能发生加成、氧化、消去等反应
C. 克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D. 莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接好装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知:乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) |
| 338.0 | 1.84 |
(1)配制反应混合液的主要操作步骤为_______________________(不必指出液体体积);制取乙酸乙酯的化学方程式为________________。
(2)上述实验中饱和Na2CO3溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.减小乙酸乙酯的溶解度,有利于其分层析出
D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是________________________________________________________。
(4)写出步骤③中观察到的现象___________________________。
(5)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤。通过洗涤可除去的杂质是________(填名称);干燥乙酸乙酯可选用的干燥剂为________(填字母)。
A.P2O5 B.无水硫酸钠
C.碱石灰 D.NaOH固体
(6)某化学课外小组设计了图乙所示的制取乙酸乙酯的装置(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有________(填字母)。

a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液,减少反应物蒸发
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com