
【题目】化学与生产、生活密切相关,下列对应关系正确的是
选项 | 性质 | 实际应用 |
A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
B | SO2具有还原性 | 漂白纸浆 |
C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暧宝贴 |
D | 氧化铝是两性氧化物 | 作耐高温材料 |
A. A B. B C. C D. D
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有族中IIIB中元素种类最多
B.p区都是主族元素
C.s区、d区、ds区都是金属元素
D.最外层电子数为2的元素都分布在s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NaHSO4的说法中正确的是( )
A.NaHSO4固体溶于水时既破坏离子键又破坏共价键
B.NaHSO4固体熔化时破坏的是离子键和共价键
C.NaHSO4固体中阳离子和阴离子的个数比为2:1
D.NaHSO4晶体是离子晶体,因此能够导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于_______区,单质X的晶体类型为____________,其中X原子的配位数为______________。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为______________________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为______________________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z、R、Q为前四周期元素,且原子序数依次增大。A是所有元素中原子半径最小的;B的核外电子排布式为ls22s22p2;X原子单电子数在同周期元素中最多;Y与X同周期,第一电离能比X的低;Z的M层电子数是K层电子数的2倍;R与Y同主族;Q的最外层只有一个电子,其它电子层电子均处于饱和状态。
回答下列问题:
(1)Q+的核外电子排布式为______,Z的价电子轨道表达式(价电子排布图)为_______。
(2)化合物XA3中X原子的杂化方式为______;A3Y+的立体构型为______。
(3)① B、Z的最高价氧化物的沸点较高的是______(填化学式),原因是______。
② Y与R的简单氢化物中Y的熔沸点更高,原因是______。
(4)向Q元素的硫酸盐溶液中通入足量XA3,充分反应后溶液呈深蓝色,该反应的离子方程式为______。
(5)B有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞中B原子数为______,B原子的配位数为______,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加德罗常数为______(用含a和p的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、X、Y、Z四种短周期元素,它们满足如下关系:①原子序数依次增大;② M 和Y组成的一种气体能使湿润的红色石蕊试纸变蓝;③ XZ分子与Y2分子中质子数相等;④ Y、Z在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体。
回答下列问题:
(l)M与X、Y形成的18e-分子的化学式分别为_____、______。
(2)经测定M2Z2为二元弱酸,M2Z2的电离方程式为______;常用硫酸与BaZ2反应来制备M2Z2_________________,
(3)由M、Y、Z三种元素组成的离子化合物M4Y2Z3,其水溶液呈酸性,用离子方程式说明原因:______________。
(4)将9gX单质在空气中充分燃烧,所得气体通入1L lmol/LNaOH溶液中,完全吸收后,溶液中各离子浓度由大到小的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量有凤梨香味的物质X,其结构如右图所示。下列说法正确的是( )
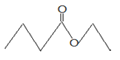
A.X难溶于乙醇
B.酒中的少量丁酸能抑制X的水解
C.分子式为 C4H8O2且官能团与X相同的物质有5种
D.X完全燃烧后生成CO2和H2O的物质的量比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A 为红棕色气体,B为强酸,X为常见金属单质。

(1) C的化学式为____________。
(2) A与水反应的化学方程式为____________。
(3)某温度下(>100℃)若mgX与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com