
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于_______区,单质X的晶体类型为____________,其中X原子的配位数为______________。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为______________________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为______________________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
【答案】 ds 金属晶体 12 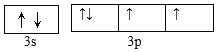 Ar H2SO4 正四面体形 16NA CuS
Ar H2SO4 正四面体形 16NA CuS 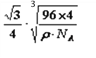
【解析】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则X的原子序数=2+8+18+1=29,为Cu元素。元素Y基态原子的3p轨道上有2个未成对电子,则Y为硅或硫元素。元素Z 的原子最外层电子数是其内层的3倍,则Z为O元素。
(1)Cu元素在元素周期表中位于ds区,单质铜为金属晶体,铜原子形成晶体时采用的堆积方式为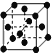 ,其中铜原子的配位数为12,故答案为:ds;金属晶体;12;
,其中铜原子的配位数为12,故答案为:ds;金属晶体;12;
(2)根据上述分析,Y为硅或硫元素,元素Y可与元素Z的相对原子质量只差为16,则元素Y为S,基态原子的外围电子排布图为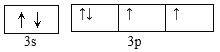 ,第3周期中,第一电离能最大的是Ar。S元素的含氧酸中,酸性最强的是硫酸,SO42-中S的价层电子对数目=4+
,第3周期中,第一电离能最大的是Ar。S元素的含氧酸中,酸性最强的是硫酸,SO42-中S的价层电子对数目=4+![]() (6+2-2×4)=4,采用sp3杂化,立体构型为正四面体形,故答案为:
(6+2-2×4)=4,采用sp3杂化,立体构型为正四面体形,故答案为: ;Ar ;H2SO4;正四面体形;
;Ar ;H2SO4;正四面体形;
(3)氯化铜与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有12molN-H,键和4mol配位键,共16mol共价键,σ键的数目为16NA,故答案为:16NA;
(4)依据晶胞结构,利用切割法分析,每个晶胞中含有铜原子个数为:8×![]() +6×
+6×![]() =4,硫原子个数为4,则化学式为;CuS;1mol晶胞中含有4molCuS,1mol晶胞的质量为M(CuS)×4,设晶胞参数为a,则晶体密度ρg·cm–3=
=4,硫原子个数为4,则化学式为;CuS;1mol晶胞中含有4molCuS,1mol晶胞的质量为M(CuS)×4,设晶胞参数为a,则晶体密度ρg·cm–3=![]() =
=![]() ,解得a=
,解得a=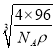 cm,则此晶胞中X与Y的最近距离为体对角线的
cm,则此晶胞中X与Y的最近距离为体对角线的![]() =
=![]() ×
×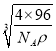 cm,故答案为:CuS;
cm,故答案为:CuS; ![]() ×
×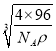 。
。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚天津港危化品发生爆炸,造成重大财产损失和人员伤亡。据报道爆炸点库存大量硝酸铵、硝酸钾、氰化钠(NaCN)、金属钠和镁等化学品。下列说法错误的是( )
A. 硝酸铵本身具有氧化还原性,受热或撞击易发生爆炸
B. 氰化钠属剧毒物质,用过氧化氢处理氰化钠现场和水污染的离子方程式:2CN-+5H2O2===2HCO![]() +N2↑+4H2O
+N2↑+4H2O
C. 爆炸发生引发大火,用大量水灭火
D. 硝酸盐等氧化性物质不能与还原性物质如钠、镁、有机化合物等存放在一起
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列物质的用途的说法错误的是( )
A.部分卤代烃可用作灭火剂
B.乙二醇可用于配制汽车防冻液
C.酚类化合物有毒,不能用于杀菌消毒
D.甲醛的水溶液(福尔马林)可用于防腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素的常见化合价有-1、0、+1、+3、+4、+5、+7。
①KClO3是一种强氧化剂,常温下较稳定,在400 ℃以上则分解并放出氧气。其分解分为两步进行:加热到356 ℃以上时分解为甲和乙,而几乎不放出氧气。当温度在400 ℃以上时,乙分解为甲和丙。其中甲是一种含氯的化合物。
②已知化合物丁由丙物质组成元素和氯元素组成,是一种红黄色有强烈刺激性臭味的气体,标准状况下密度约为3.01 g·L-1。
(1)甲的电子式为________;试比较KClO3与乙的稳定性:_________(用化学式表示)。
(2)实验室可以用KClO3和浓盐酸制备氯气,反应的化学方程式为
______________________________________________________。
(3)工业上KClO3和乙均由电解和复分解两步反应制得,其生产流程如图所示:

电解热的NaCl溶液时,产生的Cl2与NaOH反应生成NaClO3和NaCl,NaCl继续参与电极反应,最终实现向NaClO3的转化。写出该电解池中发生总反应的化学方程式:____________________________________________。
当温度低于80 ℃时,会有部分NaClO生成。若电解消耗了117 g NaCl时,电路中转移的电子为10.4 mol,则NaClO3的产率为_______(产率=![]() ×100%)。
×100%)。
(4)写出电解NaClO3生成戊时的阳极反应式:__________________。
(5)NaClO3还可用于丁的生产:将NaClO3溶液用H2SO4酸化后,通入SO2气体制得。试写出发生反应的离子方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列对应关系正确的是
选项 | 性质 | 实际应用 |
A | 活性炭可吸附水中的悬浮物 | 用于自来水的杀菌消毒 |
B | SO2具有还原性 | 漂白纸浆 |
C | 铁被氧气氧化时会放出热量 | 铁、活性炭、无机盐、水等的混合物制成暧宝贴 |
D | 氧化铝是两性氧化物 | 作耐高温材料 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究Na2CO3溶液的性质,需要配制480mL 密度为1gcm-3、质量分数为1.06%的Na2CO3溶液。
(1)所配Na2CO3溶液的物质的量浓度为______mol·L-1,所需碳酸钠的质量为_______g。
(2)配制时,提供以下仪器:烧杯、量筒、托盘天平(带砝码)、玻璃棒 ,还缺少的玻璃仪器是_____、_______。
(3)该实验两次用到玻璃棒,其作用分别是______、________。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”①定容时俯视刻度线 ②碳酸钠粉末带有部分结晶水 ③容量瓶未经干燥使用 ④称量碳酸钠时所用砝码生锈 ⑤移液过程中有少量溶液溅出
其中引起所配溶液浓度偏高的有 ____(填序号,下同),偏低的有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com